
| A. | 以焦炭和铁矿石为原料炼铁的原理是用焦炭直接还原化合态的铁 | |
| B. | 据报道,庐江磁性材料产生“磁”力无穷,磁性氧化铁的化学式是Fe2O3 | |
| C. | 为证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液 | |
| D. | 利用铁矿石制得的能除去污水中的,可知相同条件下,Ksp(FeS)>Ksp(HgS) |
分析 A.用焦炭和铁矿石为原料炼铁,实际是一氧化碳还原氧化铁得到金属铁;
B.Fe2O3俗称铁红,不具有磁性,有磁性的是四氧化三铁;
C.硝酸根离子在酸性环境下能够氧化二价铁离子生成三价铁离子,铁离子遇到硫氰化钾显示红色;
D.依据沉淀转化的原则:化学反应中,沉淀向着更难溶的方向转化.
解答 解:A.用焦炭和铁矿石为原料炼铁,其原理是碳和二氧化碳反应生成的一氧化碳还原氧化铁得到的金属铁,故A错误;
B.庐江磁性材料产业“磁”力无穷,磁性氧化铁是四氧化三铁,故B错误;
C.为证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液,不能排除二价铁离子的干扰,故C错误;
D.FeS能除去污水中的Hg2+,是因为沉淀向着更难溶的方向转化,FeS的溶解能力大于硫化汞的溶解能力,即Ksp(FeS)>Ksp(HgS),故D正确;
故选:D.
点评 本题考查了高炉炼铁的原理、铁的化合物的性质、俗称等,熟悉高炉炼铁的过程,熟悉不同价态铁的化合物的性质是解题关键,注意对知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1mol/L该溶液和足量的Ca充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| B. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度最大的离子是Na+ | B. | 溶液显酸性 | ||
| C. | c(K+)=0.05mol/L | D. | 阴离子种类多于阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用无色试剂瓶盛放浓硝酸 | B. | 用铁质容器盛放浓硫酸 | ||
| C. | 用玻璃试剂瓶盛放氢氟酸 | D. | 用带橡胶塞的试剂瓶盛放苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
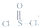 )中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )| A. | 电解质溶液中混入水,对电池反应无影响 | |
| B. | 金属锂被还原,作电池的负极 | |
| C. | 电池工作过程中,Cl-向石墨电极移动 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
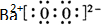 (写电子式),
(写电子式),查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:实验题
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
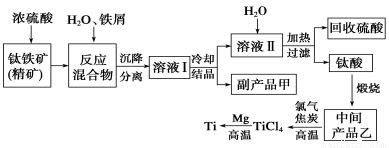
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是________。
(2)上述生产流程中加入铁屑的目的是____________________________。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol·L-1,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:________________________。
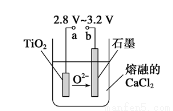
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是__________________。(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图所示。下图中b是电源的________极,阴极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
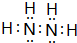 ,六个原子处在同一平面吗?否(是?否?).
,六个原子处在同一平面吗?否(是?否?).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com