
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数:Y>X | D. | 质子数:Y>X |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
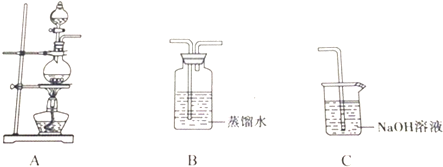
| 实验 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
| Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
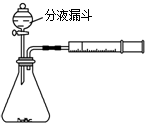 学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:
学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->F->Na+>Al3+ | |
| B. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF | |
| C. | 熔点高低:金刚石>石墨>食盐>干冰>碘晶体 | |
| D. | 沸点高低:NH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
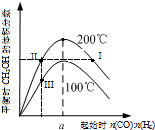 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡:c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率ν正:ν正(状态Ⅱ)>ν正(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶格能 NaCl<MgO | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 离子半径:Na+<O2- | D. | 第一电离能:P>Cl>S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com