
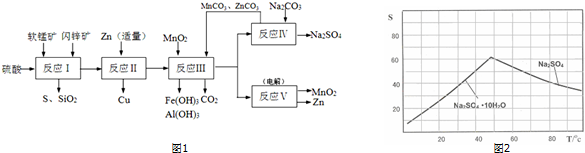
分析 (1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32-=2I-+S4O62-,MnO2~I2~2S2O32-,依据离子方程式定量关系计算,注意溶液体积的变化;
(2)生成CuSO4和MnSO4的化学方程式是MnO2,CuS在酸性溶液中发生的氧化还原反应,氧化剂为MnO2,被还原为硫酸锰,还原剂为CuS,被氧化为硫单质同时生成硫酸铜,依据电子守恒和原子守恒写出化学方程式判断;
(3)流程图分析,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会和亚铁离子反应生成铁单质;
(4)依据图象的溶解度随温度变化分析判断,得到硫酸钠的适宜条件,注意溶解度的影响;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极失电子生成,据此书写化学方程式;
(6)可以循环利用的物质是反应过程中重复使用,最后又生成可以进行循环使用.
解答 解:(1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32-=2I-+S4O62-,
MnO2~I2~2S2O32-,
1 2
n 0.1000mol•L-1×0.050L
n=0.0025mol
1L溶液中含MnO2物质的量=0.0025mol×$\frac{1000}{25}$=0.1mol,
则软锰矿中MnO2含量=$\frac{0.1mol×87g/mol}{14.5g}$×100%=60%,
故答案为:60%;
(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4和MnSO4硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O,
故答案为:2H2SO4;S;2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁;反应的离子方程式为:Zn+Fe2+=Fe+Zn2+,
故答案为:将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+;
(4)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,
故答案为:趁热过滤,防止Na2SO4固体因溶解而减少,防止Na2SO4固体转变为Na2SO4•10H2O晶体;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出,电极反应为:Zn2++2e-=Zn;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,反应的化学方程式为:MnSO4+ZnSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$Zn+MnO2+2H2SO4,
故答案为:MnSO4+ZnSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$Zn+MnO2+2H2SO4;
(6)依据流程图可知能循环使用的物质为Zn、ZnCO3、MnCO3和MnO2,
故答案为:Zn.
点评 本题考查了物质制备实验的分析判断,物质溶解性的理解应用,电解原理的应用判断.电极反应的产物判断和电极反应书写,题目难度较大.


科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变成黄色 | 氧化性:H2O2>Fe2+ |
| C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入KMnO4酸性溶液中 | KMnO4酸性溶液褪色 | 乙烯使KMnO4酸性溶液褪色 |
| D | 向a、b两支盛有KI3溶液的试管中分别加入淀粉溶液、硝酸银溶液. | a试管中溶液变蓝 b试管中产生黄色沉淀 | KI3溶液中存在平衡I3--?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的分离提纯方法之一为“筛分”,如:胶体--渗析法提纯,浊液--过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒和滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 工业上电解饱和食盐水时,为了阻止产物相互之间反应,往往用阴离子交换膜把阳极和阴极隔开 | |
| D. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,可验证Na2S2O3浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离Fe2O3、Al2O3操作依次为溶解、过滤、灼烧 | |
| B. | 粗盐可通过溶解、过滤、蒸发、结晶的方法提纯 | |
| C. | 配制氯化铁溶液,是将FeCl3溶于蒸馏水,再加入一定量的铁粉 | |
| D. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发光电转换材料,充分利用太阳能 | |
| B. | 包装材料聚氯乙烯属于烃,会造成环境污染 | |
| C. | 用石灰对煤燃烧形成的烟气脱硫,并回收石膏 | |
| D. | 研发高效生物生长调节剂,减少对化肥的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| B. | CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
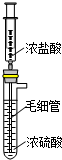 实验室用如图装置制备HCl气体.
实验室用如图装置制备HCl气体.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com