
(16分)
(1)合成氨反应反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ·mol-1
H2(g)+
F2(g)=HF(g);△H=-269kJ·mol-1
H2(g)+O2(g)=H2O(g);△H=-242kJ·mol-1
则反应 N2H4(g)+2F2(g)=N2(g)+4HF(g) 的H=_____________ kJ·mol-1。
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为______。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示此时溶液中NH3·H2O的物质的量浓度__________ mol·L-1。(说明:溶液的体积可以直接相加)
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 | B、图2中0~10min内该反应的平均速率v(H2)=0.045mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | C、图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)氨气是一种重要的基础化工原料,用途广泛。
在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2= +6H2O
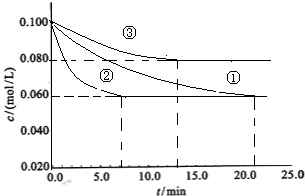
工业中常用以下反应合成氨:N2+3H22NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
(1)该反应平衡常数的数学表达式 ;实验②平衡时H2的转化率为_______
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:选择题
合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

下列说法正确的是:
A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小
B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其
它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com