
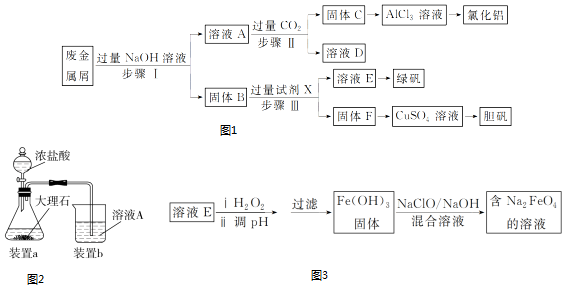
分析 Fe、Cu、Fe2O3都不与NaOH溶液反应,Al和Al2O3可与NaOH溶液反应,用含有Al、Fe、Cu和Al2O3和Fe2O3的废金属屑制取AlCl3、绿矾晶体(FeSO4•7H2O)和胆矾晶体流程为:合金中Al、Al2O3与NaOH反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成Al(OH)3固体C,生成的Al(OH)3再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为NaHCO3溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,以此解答该题.
解答 解:(1)铝、氧化铝与氢氧化钠反应,所得滤液A为NaAlO2溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+H2O;
(2)金属铁和金属铜不与氢氧化钠反应,金属铜和稀硫酸之间不反应,但是金属铁可以和稀硫酸之间反应生成硫酸亚铁和氢气,进而制的绿矾晶体,所以试剂X为稀硫酸;溶液D为NaHCO3溶液,
故答案为:稀硫酸;NaHCO3;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的HCl气体,氯化氢在水中溶解了部分沉淀,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去HCl的装置,二氧化碳在饱和NaHCO3中不溶,氯化氢和NaHCO3反应生成二氧化碳气体,所以可在装置a和b之间增加一个盛有饱和NaHCO3溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:在装置a和b之间增加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl;
(4)浓硫酸和铜在加热条件下生成二氧化硫,会污染环境,故答案为:产生污染气体二氧化硫;
(5)E为FeSO4,E被双氧水氧化生成Fe2(SO4)3,然后调节溶液pH,将Fe3+转化为Fe(OH)3沉淀,将沉淀溶于NaClO、NaOH溶液中得到Na2FeO4,
①测得溶液E中c(Fe2+) 为0.2 mol•L-1,若要处理1 m3溶液E,n(Fe2+)=0.2mol/L×1000L=200mol,
根据转移电子守恒得n(H2O2)=$\frac{200mol×1}{2}$=100mol,
理论上需要消耗25% 的H2O2溶液质量=100mol×34g/mol÷25%=3400g=13.6kg,
故答案为:13.6;
②由Fe(OH)3制取Na2FeO4的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-.
点评 本题考查物质制备,为高频考点,侧重考查学生的分析、实验和计算能力,题目涉及氧化还原反应、化学方程式的计算、离子检验、基本操作等知识点,明确化学反应原理及物质性质、基本操作是解本题关键,题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 试剂体积 V/mL | 显色时间 t/s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 26.8 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
| ④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
| ⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与NaOH溶液反应的同分异构体共有6种 | |
| B. | 存在分子中含有六元环的同分异构体 | |
| C. | 既含有羟基又含有醛基的有5种 | |
| D. | 不存在含有2个羟基的同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 | |
| B. | 雷雨天气时空气中能生成少量的氮氧化物 | |
| C. | 铵盐易溶于水,化学性质稳定,受热不易分解 | |
| D. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com