
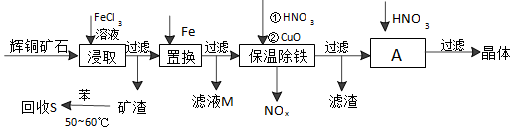
分析 辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入苯水浴加热回收硫单质;加入在滤液中加入铁还原铁离子和铜离子过滤,滤液M中加入氯气氧化反应生成氯化铁循环使用,保温除铁加入稀硝酸溶液和氧化铜反应,调节溶液pH除去杂质离子,过滤得到滤液为硫酸亚铁溶液,在稀硝酸溶液中蒸发浓缩,冷却结晶过滤洗涤得到晶体;
(1)铁离子做氧化剂被还原为亚铁离子,Cu2S被氧化,生成铜离子和硫单质;
(2)苯易挥发,温度过低溶解速率小;
(3)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀;
(4)加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质.
解答 解:(1)铁离子做氧化剂,Cu2S被氧化,离子方程式为Cu2S+4Fe3+=2Cu2++4Fe2++S,
故答案为:Cu2S+4Fe3+=2Cu2++4Fe2++S;
(2)苯沸点比较低,温度过高苯容易挥发,且温度过低溶解速率小,
故答案为:温度高苯容易挥发、温度低溶解速率小;
(3)保温除铁过程中加入CuO的目的是调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀,
故答案为:调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀;
(4)A步操作为蒸发浓缩、冷却结晶,要用硝酸调节溶液的pH,其理由是抑制Cu2+的水解,故答案为:蒸发浓缩、冷却结晶;抑制Cu2+的水解.
点评 本题考查物质的制备实验,为高考常见题型,把握制备流程及发生的反应为解答的关键,侧重于学生的分析能力和实验能力的考查,注意氧化还原反应、盐类水解的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量( mol•L -1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 实验 | 操作 |
| A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中. |
| B | 除去BaSO4中的少量BaCO3 | 加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
| C | 量取盐酸溶液 | 用25mL量筒量取4.0mol/L的盐酸5.62mL |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | K+、Ba2+、Cl-、SO42- | ||
| C. | Al3+、CO32-、NH4+、AlO2- | D. | Cu2+、NH4+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com