
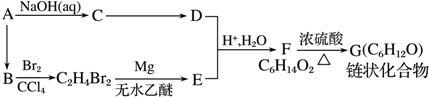
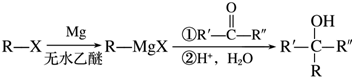 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)
分析 B与溴水反应生成C2H4Br2,则B为CH2=CH2,C2H4Br2为BrCH2CH2Br,E为BrMgCH2CH2MgBr,由F的分子式可知D为CH3CHO,则C为CH3CH2OH,A为可以为CH3CH2Br等,F为CH3CH(OH)CH2CH2CH(OH)CH3,G为链状化合物,则F中1个羟基发生消去反应生成G,则G为CH3CH=CHCH2CH(OH)CH3或者CH2=CHCH2CH2CH(OH)CH3.
(5)苯与溴在溴化铁做催化剂条件下生成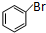 ,与Mg/无水乙醚作用得到
,与Mg/无水乙醚作用得到 ,再与乙醛反应、然后酸化生成
,再与乙醛反应、然后酸化生成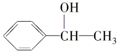 ,再发生消去反应生成
,再发生消去反应生成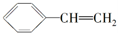 ,最后发生加聚反应得到聚苯乙烯.
,最后发生加聚反应得到聚苯乙烯.
解答 解:B与溴水反应生成C2H4Br2,则B为CH2=CH2,C2H4Br2为BrCH2CH2Br,E为BrMgCH2CH2MgBr,由F的分子式可知D为CH3CHO,则C为CH3CH2OH,A为可以为CH3CH2Br等,F为CH3CH(OH)CH2CH2CH(OH)CH3,G为链状化合物,则F中1个羟基发生消去反应生成G,则G为CH3CH=CHCH2CH(OH)CH3或者CH2=CHCH2CH2CH(OH)CH3..
(1)A→C发生卤代烃水解生成乙醇,反应类型是取代反应,A→B发生卤代烃消去反应生成影响,反应条件是氢氧化钠醇溶液、加热,G为G为CH3CH=CHCH2CH(OH)CH3或者CH2=CHCH2CH2CH(OH)CH3,所含官能团的名称是碳碳双键、羟基,
故答案为:取代反应;氢氧化钠醇溶液、加热;碳碳双键、羟基;
(2)C→D反应的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)F为CH3CH(OH)CH2CH2CH(OH)CH3,与F具有相同的碳骨架和相同的官能团种数的同分异构,可以看着正己烷为2个-OH取代,利用定一移一法可知共有8种(不含F),注意2个羟基连接同一碳原子上不稳定,
故答案为:8;
(4)满足下列条件的物质G的同分异构体:①能发生银镜反应,说明含有醛基;②核磁共振氢谱有3个峰;③含有甲基的数目最多,符合条件的同分异构体为:C(CH3)3CH2CHO,
故答案为:C(CH3)3CH2CHO;
(5)苯与溴在溴化铁做催化剂条件下生成 ,与Mg/无水乙醚作用得到
,与Mg/无水乙醚作用得到 ,再与乙醛反应、然后酸化生成
,再与乙醛反应、然后酸化生成 ,再发生消去反应生成
,再发生消去反应生成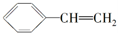 ,最后发生加聚反应得到聚苯乙烯,合成路线流程图为:
,最后发生加聚反应得到聚苯乙烯,合成路线流程图为: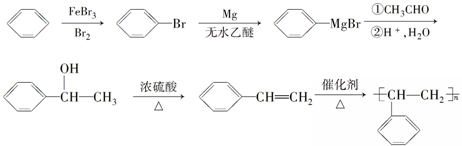 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,注意根据反应信息与有机物分子式进行推断,熟练掌握官能团的性质与转化,是对有机化学基础的综合考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
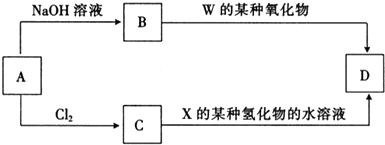
| W | X | ||
| Y | Z |
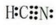 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | CCl4 | Br2 | 用NaOH溶液洗涤、分液 |
| B | FeCl3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| C | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| D | CO2 | SO2 | 通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
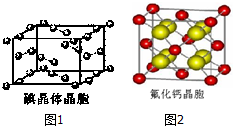 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
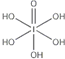 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2的体积为22.4L | |
| B. | 在0℃101KPa时,22.4L氢气中含有NA个氢原子 | |
| C. | 14g氮气中含有7NA个电子 | |
| D. | NA个CO和0.5molCH4的质量比为7:4 |
查看答案和解析>>
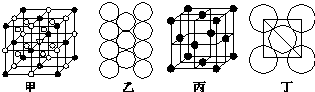
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com