
【题目】对于胃溃疡较重的病人,不适合使用的抑酸剂是 ( )
A.Mg(OH)2
B.Al(OH)3
C.NaHCO3
D.Na3C6H5O7·2H2O
科目:高中化学 来源: 题型:
【题目】下列药物知识中正确的是( )
A.OTC是处方药的标志,可以自行购药和按方法使用
B.中草药麻黄碱可用于治疗失眠等症状
C.抗生素能抵抗所有细菌感染,可以大量使用
D.凡是不以医疗为目的的滥用麻醉药品和精神药品都属于吸毒范围
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和锌是制造干电池的主要原料
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2 , 含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿] ![]() [滤液A]
[滤液A] ![]() [Zn2+、Mn2+、Fe2+、Al3+]
[Zn2+、Mn2+、Fe2+、Al3+] ![]() [ZnSO4、MnSO4溶液]
[ZnSO4、MnSO4溶液] ![]() [Zn+MnO2+产品D]
[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式: .
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2 , 其作用是另外一种固体物质可为 .
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为 . 产品D的化学式为 , 该物质对整个生产的意义是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在第二次世界大战中拯救了成千上万士兵的生命,被誉为与原子弹、雷达齐名的当时三大发明之一的药物是( )
A.青霉素
B.阿司匹林
C.麻黄碱
D.抗酸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述正确的是( ) 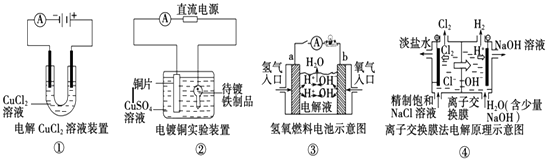
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果把2FeCl3+Cu→2FeCl2+CuCl2设计成原电池,则在正极上生成的离子是( )
A. Cl- B. Fe2+ C. Cu2+ D. Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( ) 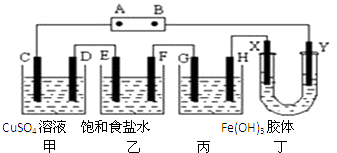
A.电源B 极的名称是负极,丁中Y极附近颜色变深
B.乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度
C.设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L
D.甲装置中电解反应的总化学方程式是:CuSO4+Fe ![]() Cu+FeSO4
Cu+FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玉石在我国有7 000多年的使用历史,2008年奥运会的奖牌就采用了“金镶玉”的形式。绿柱石又称绿宝石,是宝石中的上品,其主要成分为BexAl2Si6O18,也可以用二氧化硅和金属氧化物的形式表示,则x为( )
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有不纯的氯化铜粉末13.5 g(内含一种杂质),当与足量的AgNO3溶液反应时,生成29 g AgCl沉淀,则粉末中的杂质可能是( )
A. FeCl3 B. KCl C. ZnCl2 D. BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com