
取一定量的铁、铜混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(稀硝酸的唯一还原产物)的体积及所得剩余固体的质量记录如下(所有气体的体积均在标况下测定)
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| HNO3溶液的体积(mL) | 100 | 200 | 300 | 400 | 500 |
| 剩余固体质量(g) | 17.2 | 8 | 0 | 0 | 0 |
| 气体体积(L) | 2.24 | 4.48 | 6.72 | 7.84 | 7.84 |
(1)该实验中所用硝酸的物质的量浓度
(2)第一次实验后剩余固体为 ,第二次实验剩余固体为 (均填写化学式)
(3)求实验中每次所取混合物中铜的质量 .
考点:
硝酸的化学性质.
专题:
实验探究和数据处理题.
分析:
(1)先判断酸是否完全反应,再根据金属活动性判断反应的金属及生成的金属离子价态,根据硝酸和一氧化氮的关系式计算硝酸的物质的量,再根据浓度公式计算硝酸的物质的量浓度.
(2)根据1、2两组数据,结合采用极限法分析,确定剩余固体的成分.
(3)根据(2)分析1、2固体成分,计算1中铜的质量,1、2中铜的质量就是实验中每次所取混合物中铜的质量.
解答:
解:(1)由第一组数据可知固体有剩余.无论硝酸和什么金属反应,根据N原子守恒得,n(HNO3)=4 n(NO).
加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,所以c(HNO3)=4mol/L.
故答案为:c(HNO3)=4mol/L
(2)由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.15 mol电子).若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g.由此可知这9.2 g中应有Fe和Cu两种金属.
所以第一次实验后剩余金属为Fe和Cu.第二次实验后剩余金属只有Cu.
故答案为:Fe、Cu; Cu
(3)由以上分析可知,第二次实验后剩余铜8g,而与第一次相比少掉的9.2g中Fe和Cu都有.
设:这9.2g固体中Fe的物质的量为xmol和Cu的物质的量为ymol.
56 x+64 y=9.2 ①
2(x+y)=3×0.1 ②
解得y=0.1 mol,质量是6.4 g.
每次所取混合物中铜的质量6.4 g+8 g=14.4 g.
故答案为 14.4 g.
点评:
本题考查了硝酸的性质,分析本题要注意以下几点:
1、正确判断铁与硝酸反应生成离子的价态是解(1)的关键;
2、极限法是解(2)的好方法;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
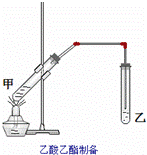
如图在试管甲中先加入2mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
(1)该实验中长导管的作用是 ,其不宜伸入试管乙的溶液中,原因是 .
(2)试管乙中饱和Na2CO3的作用是①除去乙酸乙酯中的乙醇和乙酸,② .
(3)试管乙中观察到的现象是 .
(4)试管甲中加入浓硫酸的目的是①催化剂,吸水剂② 酸 .
(5)液体混合加热时液体体积不能超过试管容积的 ,本实验反应开始时用小火加热的原因是 ;(填字母)
a.加快反应速率
b.防止了反应物未来得及反应而挥发损失
(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
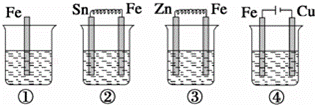
|
| A. | ③>②>④>① | B. | ②>①>③>④ | C. | ④>②>③>① | D. | ④>②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
广口瓶是中学实验中常用仪器之一,下列各装置中均有广口瓶,请填空:
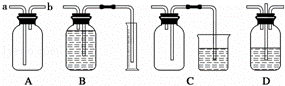
(1)装置A可用于收集气体,如H2,若装置A是干燥的,则气体应从 口进入(填“a”或“b”,下同),若A中充满水,则气体应从 口进入.
(2)装置B通常用于 ,注意事项是 .(写出两条)
(3)装置C的用途是 .
(4)装置D中长导管的作用是 ) .
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做完实验后,采用下列方法清洗所用仪器下列对以上操作的判断.正确的是( )
①用浓氨水清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗盛过苯酚的试管
⑥用热氢氧化钠的浓溶液清洗沾有硫磺的试管.
A. 除①外都对 B. 除⑥外都对 C. ④⑤不对 D. 全都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A. 在含等物质的量的AlO2﹣、OH﹣、CO32﹣的溶液中,逐滴加入盐酸:AlO2﹣、OH﹣、CO32﹣
B. 在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I﹣、Br﹣、Fe2+
C. 在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石.图1所示是利用该镁矿石制备七水硫酸镁(MgSO4•7H2O)的工艺流程,图2是CaSO4和MgSO4的溶解度曲线.
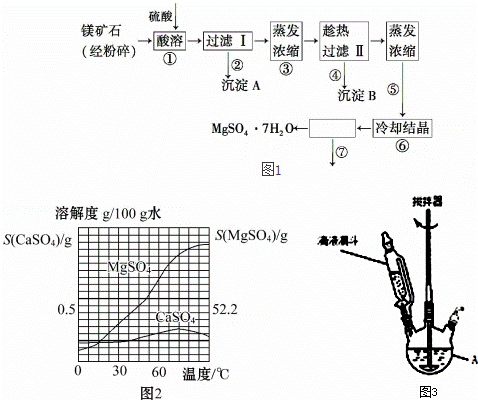
根据以上信息回答下列问题:
(1)步骤①可在图3装置中进行,仪器A的名称是 ,硫酸要分批缓慢加入的原因是 防 ,矿石要粉碎和反应过程中不断搅拌的主要目的是 ,碳酸镁与硫酸反应的化学方程式 .
(2)沉淀A的成分是SiO2和少量的 ,
(3)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和 .步骤④趁热过滤的作用是 .
(4)步骤⑦的操作名称是过滤、 、 .过滤操作时需将步骤⑥中冷却结晶后的溶液和晶体转移到漏斗中,最后器壁上往往还沾有少量晶体,需选用一种液体将器壁上的晶体淋洗并倾入漏斗中,下列液体最合适的是
A.冰水 B.滤液 C.稀硫酸 D.无水乙醇
(5)步骤⑦中洗涤晶体时,先冰水洗,后用酒精洗,用冰水洗的目的:①除去晶体表面的硫酸等杂质,② ,用酒精洗的目的是
(6)步骤⑦不宜采用加热干燥的方法,可能的原因是 .
(7)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算.步骤③需要在干燥器中进行,理由是 ;步骤⑤的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)按要求填空:周期表中电负性最大的元素的基态原子核外电子排布式 ;第三周期元素中离子半径最小的元素的价电子排布式 ; Cu2+的电子排布式: .
(2)在下列物质中:①N2、②H2S、③KOH、④MgCl2、⑤C2H4、⑥Na2O2、⑦NH4C1⑧苯(C6H6)(用序号填空)其中只含有非极性键的是 ;只含有离子键的是 ;既含有非极性键又含有极性键的是 ;含有非极性键的离子化合物是 ,上述物质存在范德华力的是 .
(3)短周期元素中,X原子核外L层中只有两对成对电子,Y原子价电子排布为nsnnpn,Z原子最外层电子数比内层电子总数少4,则YX2与 ZX2分子的空间构型依次为 、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com