
| A. | 25℃时,1L pH=ll的CH3COONa溶液中水电离出的OH-的数目为0.001NA | |
| B. | 28g乙烯和丙烯的混合气体含有的原子个数为3NA | |
| C. | 1 mol/L-l NaHCO3溶液中含有HCO3-数目小于NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
分析 A、1L pH=ll的CH3COONa溶液中,氢氧根全部来自于水的电离;
B、乙烯和丙烯的最简式均为CH2;
C、溶液体积不明确;
D、求出硫酸氢钾的物质的量,然后根据1mol液态的硫酸氢钾中含1mol阳离子来分析.
解答 解:A、1L pH=ll的CH3COONa溶液中,氢氧根的浓度为10-3mol/L,而在此溶液中氢氧根全部来自于水的电离,故溶液中水电离出的氢氧根的物质的量n=CV=10-3mol/L×1L=10-3mol,即10-3NA个,故A正确;
B、乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量为n=$\frac{28g}{14g/mol}$=2mol,故含有6mol原子即6NA个,故B错误;
C、溶液体积不明确,故溶液中的碳酸氢根的个数无法计算,故C错误;
D、6.8g硫酸氢钾的物质的量为0.05mol,而1mol液态的硫酸氢钾只能电离出1mol钾离子和1mol硫酸氢根离子,故0.05mol硫酸氢钾中含0.05mol阳离子即0.05NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
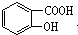 ,请回答下列问题:
,请回答下列问题: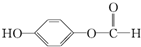 .
. ,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)C;
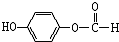
,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)C;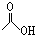 ,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为: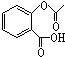 ,则阿斯匹林的分子式为C9H8O4.
,则阿斯匹林的分子式为C9H8O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未润洗就装标准液滴定 | |
| B. | 锥形瓶未用待测液润洗 | |
| C. | 滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失 | |
| D. | 读取标准液读数时,滴前仰视,滴定到终点后俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | NaOH | C. | Al2(SO4)3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2只是氧化产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4mol硫元素被氧化 | |
| D. | 每转移0.6mol电子,有0.2mol铜元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | |
| Y | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 1 L 0.l mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 等V、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 陈述Ⅰ | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对,有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com