
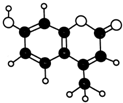
| A. | 分子式为C11H9O3 | B. | 不能使溴水褪色 | ||
| C. | 属于芳香族化合物 | D. | 不能与Na0H溶液反应 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量NaOH固体 | |
| B. | 移液前容量瓶内有水珠 | |
| C. | 摇匀后,液面低于刻度线,再加水至刻度线 | |
| D. | 定容时,俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法制铝工艺的发明使铝在生产生活中得以迅速普及 | |
| B. | 合成氨工艺的开发缓解了人类有限耕地资源与庞大粮食需求的矛盾 | |
| C. | 研究影响化学反应速率的因素对提高可逆反应的限度具有决定性作用 | |
| D. | 燃料电池的能量转换效率高具有广阔的前景 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低反应体系的压强 | B. | 增加反应物碳的用量 | ||
| C. | 缩小反应体系的体积 | D. | 减少体系中CO的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
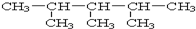 :2,3,4-三甲基戊烷.
:2,3,4-三甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 微粒 | X | Y | Na+ | A- |
| 浓度/(mol•L-1) | 8.00×10-4 | 2.50×10-10 | 0.100 | 9.92×10-2 |
| A. | 0.1mol•L-1HA溶液的pH=1 | B. | 该温度下Kw=1.0×10-14 | ||
| C. | 微粒X表示OH-,Y表示H+ | D. | 混合溶液中:n(A-)+n(X)=n(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧只生成白色的氧化钠固体 | |
| B. | 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧 | |
| C. | 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作 | |
| D. | 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
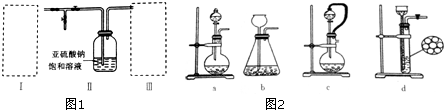
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com