
����Ŀ��ij�������Ա�Ϊ��Ҫԭ�ϣ���������·�ߺϳ�����ҩ����������
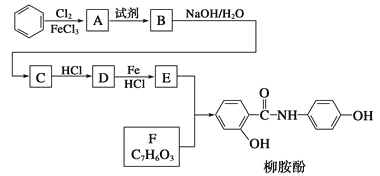
��֪��![]()
�ش��������⣺
��1��д��A��B��Ӧ������Լ�______________��A��B��Ӧ����Ϊ______________________��
��2�����������ӣ�����˵����ȷ����___________��
A.1 mol�����������Ժ�2 molNaOH��Ӧ B. �ɷ���ˮ�ⷴӦ
C. ���ܷ���������Ӧ D.�����巢��ȡ����Ӧ
��3��д��B��C�Ļ�ѧ����ʽ__________________________________��
��4��д��������F�Ľṹ��ʽ_____________________________��
��5��д��ͬʱ��������������F��ͬ���칹��Ľṹ��ʽ________________________��д��3�֣���
�����������ұ����������ֲ�ͬ��ѧ��������ԭ�ӣ� ���ܷ���������Ӧ
��6���Ա�����ϩΪԭ�Ͽɺϳɾ۱���ϩ������ƺϳ�·�ߣ����Լ����ܼ���ѡ����
ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
![]() ____________________________________��
____________________________________��
���𰸡� Ũ����/Ũ���� ȡ����Ӧ��������Ӧ�� B��D ![]()
![]()
![]() ��
��![]() ��
��![]() ��
��![]() ���������֣�
���������֣� 
��������������������ȡ����Ӧ����A��AΪ![]() ��F�в����Ͷ�=��7��2+2-6��/2=5���������ӽṹ��ʽ֪��F�к��б�����̼��˫��������FΪ
��F�в����Ͷ�=��7��2+2-6��/2=5���������ӽṹ��ʽ֪��F�к��б�����̼��˫��������FΪ![]() ��EΪ
��EΪ![]() ��D������HCl��Ӧ����E����������Ϣ֪��D�ṹ��ʽΪ
��D������HCl��Ӧ����E����������Ϣ֪��D�ṹ��ʽΪ![]() ��A��Ӧ����B��B��NaOHˮ��Һ����ȡ����Ӧ����C������D�ṹ��ʽ֪��A��Ũ���ᷢ��ȡ����Ӧ����B��BΪ
��A��Ӧ����B��B��NaOHˮ��Һ����ȡ����Ӧ����C������D�ṹ��ʽ֪��A��Ũ���ᷢ��ȡ����Ӧ����B��BΪ![]() ��CΪ
��CΪ![]() ��C��HCl��Ӧ����D��
��C��HCl��Ӧ����D��
��1��A��Ũ���ᷢ��ȡ����Ӧ����B��A��B��Ӧ������Լ�Ũ����/Ũ���ᣬA��B��Ӧ����Ϊȡ����Ӧ��������Ӧ������2��A���������з��ǻ����ļ�ˮ�����ɵ��Ȼ��ܺ�NaOH��Ӧ������1mol�����������Ժ�3mol NaOH��Ӧ���ʴ���B�������ļ������Կɷ���ˮ�ⷴӦ������ȷ��C���������к��б��������Է���������Ӧ���ʴ���D�����з��ǻ�����ͱ����Ϸ��ǻ��ڶ�λ��ԭ�ӷ���ȡ����Ӧ������ȷ����ѡBD����3��B��NaOHˮ��Һ����ȡ����Ӧ����C��B��C�Ļ�ѧ����ʽ��![]() ����4��������F�Ľṹ��ʽ
����4��������F�Ľṹ��ʽ![]() ����5��F��
����5��F��![]() ����ͬ���칹��ͬʱ�����������������������ұ����������ֲ�ͬ��ѧ��������ԭ�ӣ��ܷ���������Ӧ������ȩ��������γɵ�����������������3��ͬ���칹��Ϊ��
����ͬ���칹��ͬʱ�����������������������ұ����������ֲ�ͬ��ѧ��������ԭ�ӣ��ܷ���������Ӧ������ȩ��������γɵ�����������������3��ͬ���칹��Ϊ��![]() ��
��![]() ��
��![]() ��
��![]() ���������֣�����6���ڴ��������£�������ϩ�����ӳɷ�Ӧ���ɱ����飬�ڹ��������£������鷢��ȡ����Ӧ����
���������֣�����6���ڴ��������£�������ϩ�����ӳɷ�Ӧ���ɱ����飬�ڹ��������£������鷢��ȡ����Ӧ����![]() ���ڼ��������£�
���ڼ��������£�![]() ���������ƵĴ���Һ������ȥ��Ӧ���ɱ���ϩ���ڴ��������£�����ϩ�����Ӿ۷�Ӧ���ɾ۱���ϩ��������ϳ�·��Ϊ��
���������ƵĴ���Һ������ȥ��Ӧ���ɱ���ϩ���ڴ��������£�����ϩ�����Ӿ۷�Ӧ���ɾ۱���ϩ��������ϳ�·��Ϊ��
![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ����ԭ�ϣ��������һ������ʯ�ͻ�����չˮƽ�ı�־����ش�
��1����һ�������£��������ϩ�����Ʊ�������(CH3CH2Cl)��
���������Ʊ�������Ļ�ѧ����ʽ��______________________���÷�Ӧ��������________��
������ϩ�Ʊ�������Ļ�ѧ����ʽ��__________���÷�Ӧ��������________���Ƚ��������ַ�������______�ַ������á���ԭ����___________________________��
��2�����⣬��ϩ�������������������飬����������Ҫ�����֣�
![]()
![]()

ԭ���������DZ����õ�ԭ����������ԭ������ԭ�������ʾ����˻�ѧ�����з�Ӧ��ʹ�ó̶ȡ�������ɫ��ѧ��ԭ�����������������ԭ�Ӿ����Ժõķ�Ӧ������һ��ԭ��������_______100%(����<������������>������ͬ)�����ն���ԭ��������_______100%����ˣ���ʵ�������У����ù���________�������������á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�ش��������⣺
��1��������֮�䣬����ͬλ�ص���������ĸ��������ͬ����������� �� A�����Ͱ��� B��뭺�� C��������Һ��
D�����ɱ� E�������ͳ��� F��13C��14C
��2�������м������ʣ����Ȼ�� �ں��� ���Ȼ�þ �ܶ�����̼ ���Ȼ��� �������� ���У�a��ֻ�����Ӽ��������������ţ���ͬ����
b��ֻ�����ۼ��������� �� ���ĵ���ʽΪ�� ��
c���������Ӽ��ֹ��ۼ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü���ȼ�ϵ�ص�ⱥ��ʳ��ˮ�Ʊ�Ư��Һ������˵��������ȷ������ ��
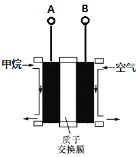
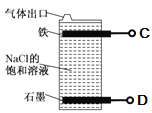
A��ȼ�ϵ�ص�A�����ӵ��ص�C��
B��A�缫�ĵ缫��ӦʽΪ��CH4��8e����2H2O = CO2��8H��
C��ȼ�ϵ�ع���ʱH���������
D�������ܷ�ӦʽΪNaCl��H2O![]() NaClO��H2��
NaClO��H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������γɵ�����Ĥ��������Ȼ����Ĥ��ĥ�ԡ���ʴ�Լ�װ���������Ե���ߣ���ҵ������Ϊ����������������Һ�е�����Ƶ���������Ĥ��װ����ͼ��ʾ������˵����ȷ����(����)
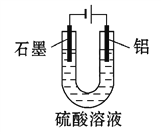
A. �����缫����ʽΪAl-3e-+6OH-Al2O3+H2O
B. ���ŵ��Ľ��У���Һ��pH������
C. ��������������3.36 L(��״��)ʱ����������2.4 g
D. ��������H+�������缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���0.6 mol A��0.5 mol B����0.4 L�ܱ������з���2A(g)+B(g)![]() mD(g)+E(g)������5 min��ﵽ��ѧƽ�⣬��ʱ���DΪ0.2 mol����֪5 min����E��ʾ��ƽ����Ӧ����Ϊ0.1 mol��L-1��min-1�����н�����ȷ����(����)
mD(g)+E(g)������5 min��ﵽ��ѧƽ�⣬��ʱ���DΪ0.2 mol����֪5 min����E��ʾ��ƽ����Ӧ����Ϊ0.1 mol��L-1��min-1�����н�����ȷ����(����)
A. A��B��ת����20% B. mֵΪ2
C. ���¶��£���Ӧ��ƽ�ⳣ��KΪ1.33L��mol-1 D. ƽ��ʱ����������ʵ���Ϊ1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�շ��Dzⶨ�л����������ʽ��һ����Ҫ��������ȫȼ��0.05molij��A��ȼ�ղ�������ͨ������Ũ���ᡢ��ʯ�ң���������Ƶ�Ũ��������5.4g����ʯ������11g����
��1�������ķ���ʽΪ����������
��2��д����A���п��ܴ��ڵĽṹ��ʽ��
��3������A��һ��ȡ������ֻ��һ�֣�д��A��������Ӧ����һ�����Ļ�ѧ����ʽ��
��4���������У�����A��ͬϵ�����һ�ȴ������ֻ��һ�ֵ����� A��C3H8 B��C2H4 C��C8H18 D��C6H14
��5����120��C��101Kpa�������£�ij��̬����һ��������������ϵ�ȼ����ȫ��Ӧ���ٻָ���ԭ�����¶�ʱ������������䣬����������� ��
A.CH4
B.C2H2
C.C2H4
D.C2H6 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����á���ѧ������ʵ���е�Ӧ�á����֪ʶ��գ�
��1��147g H2SO4�����ʵ����� �� ���к���ԭ����Ϊ����
��2��12.4g Na2R��Na+ 0.4mol����Na2R��Ħ������Ϊ �� ��R������Ϊ1.6g��Na2R�������ʵ���Ϊ ��
��3���ڱ�״���£�CO��CO2�Ļ�����干39.2L������Ϊ61g����������������ʵ���֮��mol������COռ�������%��
��4��448mLij�����ڱ�״���µ�����Ϊ1.28g������������Է�������Ϊ ��
��5��ij�������NaCl��MgCl��AlCl3��ɣ���֪Na��Mg��Al��Ԫ�ص�����֮��Ϊ23��16��9����NaCl��MgCl2��AlCl3���ʵ���֮��Ϊ �� ��1.00mol Cl���ĸû���������Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���ȶ��ԣ�HI>HBr>HCl B. Ԫ�طǽ����ԣ�P>S>Cl
C. ԭ�Ӱ뾶��S>C1>F D. ���ԣ�Mg(OH)2>KOH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com