
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
分析 A.HClO有毒,能使蛋白质发生变性;
B.硅胶可吸收水,且无毒;
C.石灰水的浓度小,不利于制备漂白粉;
D.纤维素的成分为多糖,而合成纤维中含为加聚、缩聚产物.
解答 解:A.福尔马林能使蛋白质变性,且有毒,不能用作食品保鲜剂,故A错误;
B.硅胶具有疏松多孔的结构,可吸收水,且无毒,常用作催化剂载体和食品干燥剂,故B正确;
C.Ca(OH)2微溶于水,澄清的石灰水浓度太小,不能制取漂白粉,应利用氯气与石灰乳制备,故C错误;
D.纤维素的主要成分是多糖,合成纤维的成分不是纤维素,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质及应用等为解答的关键,侧重分析与应用能力的考查,注意化学与生活的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
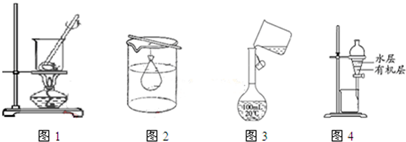
| A. | 图1:实验室灼烧胆矾测定胆矾中结晶水的含量 | |
| B. | 图2:除去Fe(OH)3胶体中的FeCl3 | |
| C. | 图3:向容量瓶中转移液体 | |
| D. | 图4:用苯萃取溴水中的Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com