考点:化学平衡状态的判断,用盖斯定律进行有关反应热的计算,化学电源新型电池,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)①平衡状态的标志可以两个方两去判断,一、是看正逆反应速是否相等,二是各组分的浓度和分数是否随时间的改变而改变;也可以抓住未平衡时是个变量,现在不变说明已经达到平衡状态了,来解决问题;
②根据外界条件的改变来判断平衡移动方向,然后去分析分子和分母的变化情况;③用三行式来求平衡时的各组分浓度,然后代入平衡常数表达式求解,要注意代入平衡常数表达式是平衡浓度,平衡常数是温度的函数,温度变平衡常数才变,到底如何变,还要看反应的热效应;
(2)①首先根据氢离子的移动方向来确定正负极,然后根据原电池原理,最后书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解;
(3)应用盖斯定律解题,始终抓住目标反应和已知反应之间的关系应用数学知识来解.
解答:
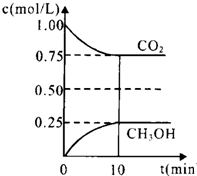
解:(1)①未平衡时是个变量,现在不变说明已经达到平衡状态了,
A.未平衡CO
2的体积分数是个变化的量,现在混合气体CO
2的体积分数保持不变,说明已经平衡了,故A正确;
B.未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故B正确;
C.单位时间内每消耗1.2mol H
2,向正方向,同时生成0.4mol H
2O,也向正方向,不能反映正逆反应之间的关系,故C错误;
D.反应中H
2O与CH
3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;
故选AB;
②A.升高温度,平衡逆向移动,故比值减小,故A不选;
B.恒温恒容下充入He(g),平衡不移动,故比值不变,故B不选;
C.将H
2O(g)从体系中分离,平衡正向移动,故比值变大,故选C;
D.恒温恒容再充入2mol CO
2和3mol H
2,相当于增大压强,平衡正向移动,故比值变大,故选D;
故答案为CD;
③CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=
=0.20,
而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应量放热反应,降低温度,K值变大,故答案为:0.20;c;
(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH
3OH-6e
-+H
2O=CO
2+6H
+,故答案为:CH
3OH-6e
-+H
2O=CO
2+6H
+;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl
-+2H
2O
H
2↑+Cl
2↑+2 OH
-,pH值变为13时,pOH=1,C(OH
-)=10
-1mol/L,n(OH
-)=10
-1mol/L×300mL×10
-3L/mL=0.03mol,由方程式CH
3OH-6e
-+H
2O=CO
2+6H
+,2Cl
-+2H
2O
H
2↑+Cl
2↑+2 OH
- 可知 CH
3OH~6e
-~6OH
- 32g 6mol
m(CH
3OH) 0.03mol
则m(CH
3OH)=32g×0.03mol÷6mol=0.16g,
故答案为:2Cl
-+2H
2O
H
2↑+Cl
2↑+2 OH
-;0.16g;
(3)应用盖斯定律解题,△H=-△H
1-△H
2+
△H
3+2△H
4=-(
c+2d-a-b)kJ?mol
-1,所以CH
3OH(l)燃烧热的热化学方程式为CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-(
c+2d-a-b)kJ?mol
-1,故答案为:CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-(
c+2d-a-b)kJ?mol
-1
点评:本题考查了化学平衡的有关知识,电极反应式的书写,以及盖斯定律的应用,综合性强,但难度不大.

 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.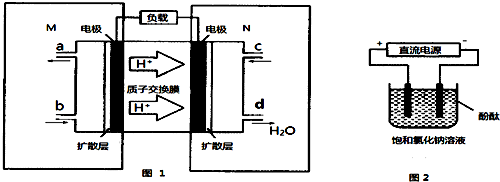


 乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示.下列说法不正确的是( )
乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示.下列说法不正确的是( )