
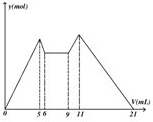
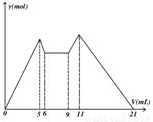
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之 后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之 后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是

 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
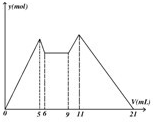 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之 后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之 后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )查看答案和解析>>
科目:高中化学 来源:2014届度黑龙江大庆实验中学高一上学期期末考试化学试卷 题型:选择题
如图是向MgCl2、AlCl3混合液中依次加入M和N时生成沉淀的物质的量与加入的M和N的体积关系图(M、N各表示盐酸或氢氧化钠溶液中的一种),以下结论不正确的是
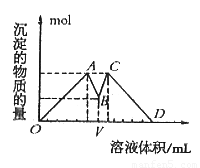
A.混合溶液中c(AlCl3):c(MgCl2)=1:1
B.混合溶液中c(AlCl3):c(MgCl2)=3:1
C.V之前加NaOH溶液,V之后加盐酸
D.这种盐酸与NaOH溶液中溶质的物质的量浓度相同
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省汕头市濠江区金山中学高三(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com