
(14分)Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W原子最外层电子数与核外电子总数之比为3∶4,Q、Y的氧化物是导致酸雨的主要物质,X是地壳中含量最高的金属元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。以下问题均有化学用语回答
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(3)Na2Y溶液中离子浓度由大到小的顺序为____________________________________________。
 (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(5)ZCl2溶液中混有FeCl3杂质时,可加入_____________(填试剂)调节pH=_________,再过滤。已知:Fe(OH)3的Ksp=10-35 ,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。
(6)工业上可用高温条件下Z2Y + O2=2Z + YO2来冶炼金属Z,生成1molZ时转移____mol电子。
 (1)
(1)
 (1分) S2->O2->Al3+(2分)
(1分) S2->O2->Al3+(2分) (2)Al2S3 + 6H2O=2Al(OH)3 ↓+ 3H2S↑(2分)
(2)Al2S3 + 6H2O=2Al(OH)3 ↓+ 3H2S↑(2分)
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (2分)
 (4)3CuO + 2NH3
(4)3CuO + 2NH3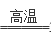 3Cu + N2 + 3H2O (2分)
3Cu + N2 + 3H2O (2分)
(5)CuO(1分) pH=4 (2分) (6)3 (2分)
【解析】
试题分析:Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。Q、Y的氧化物是导致酸雨的主要物质,则Q是氮元素,Y是硫元素。X是地壳中含量最高的金属元素,因此X是铝元素。Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,所以Z是铜元素。W原子最外层电子数与核外电子总数之比为3∶4,且原子序数介于氮元素与铝元素之间,因此W是氧元素,则
 (1)氮气分子中含有氮氮三键,单质的电子式为
(1)氮气分子中含有氮氮三键,单质的电子式为 。
。 离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。
离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。
 (2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3 ↓+ 3H2S↑。
(2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3 ↓+ 3H2S↑。
(3)Na2S溶液中硫离子水解,溶液显碱性,则溶液中离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
 (4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3
(4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3 3Cu + N2 + 3H2O。
3Cu + N2 + 3H2O。
(5)由于除杂时不能引入新的杂质,则CuCl2溶液中混有FeCl3杂质时,可加入CuO 调节pH。当溶液中铁离子浓度为1×10-5mol/L时,此时溶液中氢氧根离子浓度为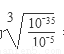 =10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。
=10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。
(6)根据Cu2S + O2=2Cu +SO2可知,只有硫元素的化合价从-2价升高到+4价,失去6个电子,因此生成1molZ时转移3mol电子。
考点:考查元素推断、常见化学用语、溶度积常数、溶液中离子浓度大小比较以及氧化还原反应计算


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于下图所示原电池装置的叙述中,正确的是
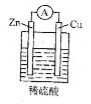
A.铜片是负极
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三年级总复习质量检测三理综化学试卷(解析版) 题型:选择题
某充电电池的原理如图所示,溶液中c(H+)=2.0 mol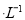 ,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
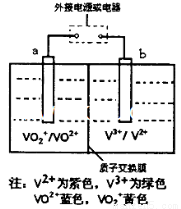
A.放电过程中,左槽溶液颜色由黄色变为蓝色
B.充电时,b极接直流电源正极,a极接直流电源负极
C.充电过程中,a极的反应式为: VO2++2H++e-= VO2++H2O
D.放电时,H+从左槽迁移进右槽
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:简答题
(18分)工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物 的处理过程。
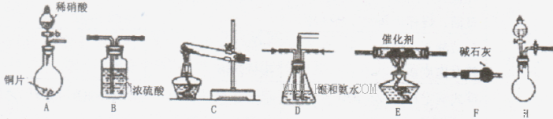
I.探究制取NH3的方法
(1)B装置的名称:______________
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为_________ 。
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
分析表中数据,你认为哪种方案制取氨气的效果最好________(填序号),从该方案选择的原料分析制气效果好的可能原因是________,__________。
试剂组合序号 | 固体试剂 | NH3体积(mL) | ||
a | 6.0gCa(OH)2过量 | 5.4gNH4Cl | 1344 | |
b | 5.4g(NH4)2SO4 | 1364 | ||
c | 6.0gNaOH过量 | 5.4gNH4Cl | 1568 | |
d | 5.4g(NH4)2SO4 | 1559 | ||
e | 6.0gCaO过量 | 5.4gNH4Cl | 1753 | |
f | 5.4g(NH4)2SO4 | 1792 | ||
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)。

(2)A中反应的离子方程式为__________________________
(3)D装置的作用有:_____________、____________、_____________。
(4)D装置中的液体还可换成 (填序号)。
A.H2OB.CCl4C.浓H2SO4D.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是___________.
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
关于原子结构、元素性质的说法正确的是
A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.在化学反应中,原子首先失去的电子能量最低
D.在元素周期表中,各主族元素的最高化合价与其族序数相等
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三第五次月考理综化学试卷(解析版) 题型:选择题
若用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA
C.常温常压下,20 g D2O含有的原子总数为3NA
D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:填空题
Ⅰ、有下列五种烃:① 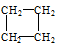 ②
② 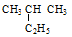 ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤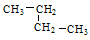 ,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,
,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,
② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是 (填序号)
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
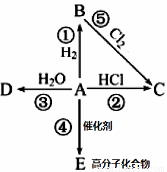
(1)写出A的电子式 ,E的结构简式为
(2)写出下列反应化学方程式,并注明③⑤反应类型
② _____________________________________________
③ _____________________ ,反应类型________;
⑤ _____________________ ,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
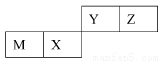
| Y | Z | |
M | X |
| |
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2 周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+ O2(g) △H=+765.2 kJ/mol (I)
请回答下列问题:
(1)请在方框内的坐标系中,画出反应(I)在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
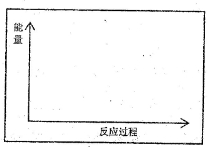
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3日生成量的建议: 。
(3)写出工业上用H2和N2直接合成NH3的化学方程式 ,设在2.0 L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总物质的量之比)为4/7。计算该条件下N2的平衡转化率为 ;反应的平衡常数K= (不要求写单位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com