
| X | Y | ||
| Z | M | R |
| A、气态氢化物稳定性:X>Y |
| B、最高价氧化物的水化物的酸性:Y>M |
| C、Z单质是一种常用的半导体材料 |
| D、Z、M、R的原子半径依次增大,最高化合价依次升高 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用电池外壳的金属材料 |
| B、不使电池中泄漏的电解液腐蚀其他物品 |
| C、回收其中石墨电极 |
| D、防止电池中汞、镉和铅等重金属离子对水和土壤的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
| B、蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质 |
| C、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D、离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
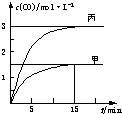 一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.
一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、1mol H2O | 1mol CO、1mol H2 | 4mol C、2mol H2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.01 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com