
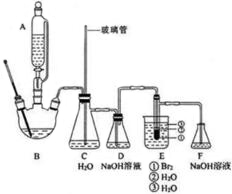
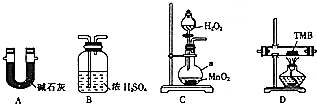
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2-二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
分析 合成1,2-二溴乙烷.装置B:乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯和水,装置C:平衡气压,装置D:用氢氧化钠溶液除去SO2、CO2,装置E:溴与乙烯发生反应,装置F:尾气吸收.
(1)根据浓硫酸密度大于乙醇和乙酸,且混合过程中浓硫酸放出大量热进行解答;乙醇沸点低,使用冰水浴降温可防止乙醇挥发;
(2)为防止暴沸,装置B中还应加入碎瓷片,B装置产生乙烯气体,装置C有竖直的玻璃管,与空气相通,可以稳定装置中的压强,起安全瓶作用,溴易挥发,E中试管里加水的目的是防止溴挥发;
(3)乙烯和溴水发生了加成反应,溴水褪色;为防止倒吸,反应结束时正确的操作是断开DE之间的导管,再停止加热;
(4)根据洗涤操作选择玻璃仪器;
(5)根据反应方程式CH2=CH2+Br2→BrCH2CH2Br可知,8.0g的溴和足量的乙醇制备1,2-二溴乙烷的质量为9.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)通入乙烯气体速率过快,影响乙烯吸收,未除掉乙烯中的杂质影响产品质量,溴、1,2-二溴乙烷挥发需液封防止挥发.
解答 解:(1)浓硫酸密度较大,混合过程会放出大量热,所以正确操作方法为:先向试管中加入乙醇,然后边振荡边慢慢加入浓硫酸,乙醇沸点低,温度高易挥发,使用冰水浴降温可防止乙醇挥发,
故答案为:先加乙醇,再加浓硫酸;防止乙醇挥发;
(2)乙醇沸点低,加热易沸腾,装置B中还应加入碎瓷片引入汽化中心,防止暴沸,B装置产生乙烯气体,装置C有竖直的玻璃管为安全管,与空气相通,当C压力过大时,安全管中液面上升,使C瓶中压力稳定,并能发现装置是否堵塞,能平衡气压,液溴有强挥发性,反应放热,产物1,2-二溴乙烷也能的挥发,水可以起保护作用,减少产品挥发引起的损失,所以E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发,
故答案为:碎瓷片;平衡气压;防止溴、产物1,2-二溴乙烷挥发;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色,为防止倒吸,反应结束时正确的操作是断开DE之间的导管,再停止加热,
故答案为:E中试管里的液体变为无色;断开DE之间的导管,再停止加热;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层,所以需要的玻璃仪器为:分液漏斗、烧杯,
故答案为:分液漏斗、烧杯;
(5)根据反应方程式CH2=CH2+Br2→BrCH2CH2Br可知,8.0g的溴和足量的乙醇制备1,2-二溴乙烷的质量为9.4g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{6.3g}{9.4g}$×100%≈67%,
故答案为:67%;
(6)a.乙烯通入溴时迅速鼓泡,部分乙烯未被吸收,产量偏低,故选;
b.装置D:用氢氧化钠溶液除去SO2、CO2,实验室没有装置D,二氧化硫能与溴水反应生成硫酸和氢溴酸,产量偏低,故选;
c.液溴有强挥发性,反应放热,产物1,2-二溴乙烷也能的挥发,水可以起保护作用,减少产品挥发引起的损失,若去掉装置E烧杯中的水,产量偏低,故选;
d.装置F尾气吸收,其中的NaOH溶液用水代替,无影响,故不选.
故答案为:abc.
点评 本题考查了1,2-二溴乙烷的实验室制备和性质的检验,明确制备原理是解题关键,注意掌握乙醇、乙烯性质及检验方法,题目难度中等.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题

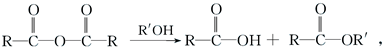

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 往燃煤中混入生石灰,可减少SO2排放 | |
| D. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
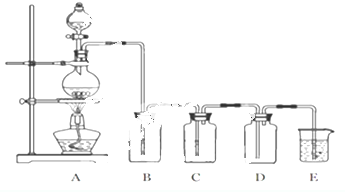
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验操作 | 现象 | 结论 | |
| A | 在淀粉溶液中加入稀硫酸加热一段时间后冷却至室温,再加入碘水. | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 水解的产物中没有葡萄糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.
由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 氢氧化钠溶液可以除去尾气NO2 | NO2是酸性氧化物,可与碱液反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 用浸有酸性高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾能还原水果释放的催熟剂乙烯 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl | K2CO3与NH4Cl反应会生成氨气降低肥效 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
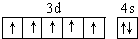 ,在其化合物中,最高正价是+7;
,在其化合物中,最高正价是+7;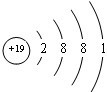 ;
;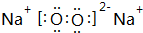 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com