
| A. | ③⑤ | B. | ②④ | C. | ③④ | D. | ①④ |
分析 反应中C为固体,增加固体的量对反应速率没有影响,改变体积或压强,只有反应反应物质的浓度发生变化时,反应速率才发生改变,以此解答该题.
解答 解:①增加C的量,物质的浓度不变,反应速率不变,故正确;
②增加CO的量,气体浓度增大,反应速率增大,故错误;
③将容器的体积缩小一半,气体浓度增大,反应速率增大,故错误;
④保持体积不变,充入N2使体系压强增大,但参加反应的物质的浓度不变,反应速率不变,故正确;
⑤增加反应体系的温度,活化分子百分数增大,反应速率增大,故错误;
⑥保持压强不变,充入N2使体系体积增大,参加反应的气体的浓度减小,反应速率减小,故错误.
故选D.
点评 本题考查化学反应速率的因素,为高考高频考点,侧重于学生的分析能力和基础知识的考查,有利于化学科学素养的培养和提高学生学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 ml,1mol/LFe2(SO4)3溶液和250mL 3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中.Na+的物质的量浓度为lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×l0-15 | B. | 1.0×10-14 | C. | 1.0×10-13 | D. | l.0×l0-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
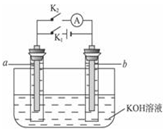 如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| B. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| C. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 涤纶、锦纶、蚕丝都属于合成纤维 | |
| B. | 塑料、液晶高分子和合成橡胶被称为三大合成材料 | |
| C. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 | |
| D. | 酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com