
【题目】(1)已知下列数据:
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,试根据表中及图中数据计算N-H的键能______________。

(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式______________________________。
(3)若用标准状况下4.48LO2氧化N2H4至N2,整个过程中转移的电子总数为___________(阿伏加德罗常数用NA表示)。
【答案】390 kJ·mol-1 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1 0.8NA
【解析】
(1)先求出此反应的焓变,根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)利用盖斯定律计算;
(3)利用得失电子守恒计算。
(1) 反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出300kJ-254kJ=46kJ热量,则反应的热化学方程式为![]() △H=-92 kJ·mol-1 。反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则
△H=-92 kJ·mol-1 。反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则![]() ,解得x=390kJmol-1,故答案为:390 kJ·mol-1;
,解得x=390kJmol-1,故答案为:390 kJ·mol-1;
(2)据盖斯定律,②×2-①得肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH=-1048.9 kJ·mol-1;
(3) 4.48LO2的物质的量为0.2mol,N2H4转化成N2,N元素的化合价由-2价上升到0价,氧元素由0价下降到-2价,故0.2mol O2转移0.2mol×4=0.8mol电子,个数为0.8NA。


科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:( )
CO(g)+H2(g)在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:( )
①升温 ②增加C的量 ③将容器的体积缩小一半 ④保持体积不变,充入He使体系压强增大 ⑤保持压强不变,充入He使容器体积变大
A. ②④ B. ②③ C. ①③ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是

A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)某温度,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(4)若在(3)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为__________,CO2的物质的量为__________。
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定
(5)根据研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ·mol-1
4NH3(g)+3O2(g) ΔH=akJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的
②已知:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京航空航天大学教授偶然中发现米虫吃塑料,受此启发进行了系列实验,证实黄粉虫的肠道微生物可降解聚苯乙烯(PS),蜡虫可降解聚乙烯(PE)。聚苯乙烯在虫肠内降解的示意图如下,下列说法正确的是

A. 在虫肠内微生物作用下,聚苯乙烯断裂碳碳双键
B. 在虫肠内微生物作用下,聚苯乙烯直接降解为CO2分子
C. 在虫肠内微生物作用下,聚苯乙烯发生降解,分子量降低
D. 聚乙烯与聚苯乙烯是同系物,具有烯烃的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
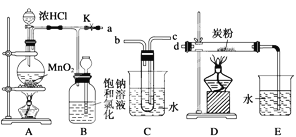
(1)C中试管中装有试剂水,要将C装置接入B和D之间,正确的接法是:a→___→___→d。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是___。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___。
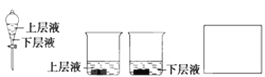
(4)用量筒量取20mLE中溶液,倒入分液漏斗中,然后再注入10mLCCl4,盖好玻璃塞(如图),振荡,静置于铁架台上,等分层后取上层液和下层液,再装入如图所示的烧杯中,能使有色布条褪色的是__(填“上层液”或“下层液”)。
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由___ ,并在方框中画出改进后的装置___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是
A. 反应I在较低的温度下可自发进行
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s) ![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列证据能说明反应一定达到化学平衡状态的是
2SO3(g),下列证据能说明反应一定达到化学平衡状态的是
A.容器内的压强不再改变B.c(SO2):c(O2):c(SO3)=2:1:2
C.混合气体的密度不再改变D.SO2的生成速率与SO3的消耗速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列各实验装置的叙述中,不正确的是
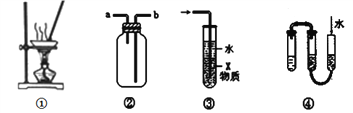
A. 装置①可用蒸发操作,蒸干FeSO4溶液获取FeSO4·7H2O晶体
B. 装置②可用于收集H2、Cl2、SO2、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④所示方法可检查该装置的气密性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com