
【题目】下列物质与水混合后静置,不出现分层的是
A. 苯 B. 乙醇 C. 氯仿 D. 正戊烷
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表所示:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)在第5 s时,NO的转化率为________。
(2)如图中表示NO2变化曲线的是______。
用O2表示0~2 s内该反应的平均速答题率v=_______。
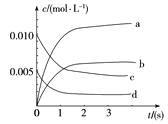
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。回答下列问题:
(1)五种元素中,原子半径最大的是____________(填元素名称),非金属性最强元素的是___________。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是
______________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是____________________;
元素D最高价氧化物的水化物的化学式为_________________。
(5)单质E与水反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不涉及化学反应的是
A. 含活性炭、细铁、食盐及蛭石等的暖手宝,在被使用时会发热
B. 用活性炭口罩防护空气中的粉尘等有害物质
C. 汽车排气管安装尾气催化转化装置
D. 通过煤的气化获得水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为 0.1 mol/L、体积为 V L 的氨水中逐滴加入 0.1 mol/L 的盐酸,下列 各选项中数值变大的有
![]()
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,在酸性条件下CNO-继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
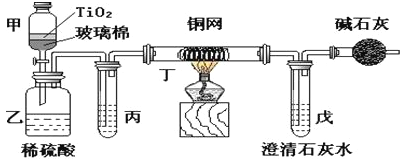
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 molL-1倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为________________________,乙中反应的离子方程式为________________________。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是_____________________,丁在实验中的作用是______________,装有碱石灰的干燥管的作用是______________________________。
(3)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于__________。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能原因之一_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
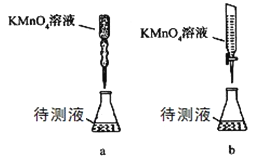
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。
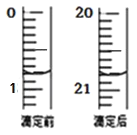
(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)本生(Bunsen)热化学循环吸收SO2工艺由下列三个反应组成:
2H2(g)+O2(g)=2H2O(l) △H1=-572kJ·mol-1
2HI(g)=H2(g)+I2(g) △H2=+10kJ·mol-1
2H2SO4(l)=2SO2(g)+2H2O(l)+O2(g) △H3=+462kJ·mol-1
则得
SO2(g)+I2(g)+2H2O(I)=2HI(g)+H2SO4(I) △H=_______kJ·mol-1
(2)氧化锌吸收法。配制ZnO悬浊液,在吸收塔中封闭循环脱硫。测得pH、吸收效率η随时间t的变化如图1所示;溶液中部分微粒与PH的关系如图2所示。

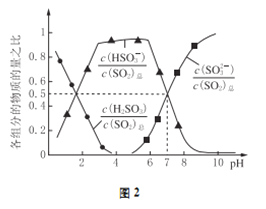
①为提高SO2的吸收效率η,可采取的措施有:增大悬浊液中ZnO的量、________________。
②图1中的pH-t曲线ab段发生的主要化学方程式为___________________
③pH=7时,溶液中![]() =________
=________
(3)如图3所示,利用惰性电解电解含SO2的烟气回收S及H2SO4,以实现废物利用。

①阴极的电极反应式为_____________。
②每处理含19.2g SO2的烟气,理论上回收S、H2SO4的物质的量分别为______、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有pH=5的CH3COOH溶液10 mL,要使pH增大3,可采取的方法有( )
A. 向溶液中加水稀释至10 L B. 加入一定量的NaOH固体
C. 加入一定量pH=8的NaOH溶液 D. 加入一定浓度的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com