
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
分析 A.I中的反应2NO2(g)?2NO(g)+O2 (g)
开始(mol/L)0.6 0 0
反应(mol/L)0.4 0.4 0.2
平衡(mol/L)0.2 0.4 0.2
化学平衡常数K=$\frac{0.{4}^{2}×0.2}{0.{2}^{2}}$=0.8
容器体积为1L,则平衡时I中气体总物质的量=1L×(0.2+0.4+0.2)mol/L=0.8mol,
恒容恒温时气体压强之比等于其物质的量之比,如果平衡时I、II中压强之比为4:5,则II中平衡时气体总物质的量为1mol,II中开始时浓度商=$\frac{0.{5}^{2}×0.2}{0.{3}^{2}}$=$\frac{5}{9}$<0.8,则平衡正向移动;
B.如果II中平衡时 c(NO2)=c(O2),设参加反应的 c(NO2)=xmol/L,则0.3-x=0.2+0.5x,x=$\frac{1}{15}$,
平衡时 c(NO2)=c(O2)=$\frac{7}{30}$mol/L,c(NO)=0.5mol/L+$\frac{1}{15}$mol/L=$\frac{17}{30}$mol/L,II中$\frac{(\frac{17}{30})^{2}×\frac{7}{30}}{(\frac{7}{30})^{2}}$≈1.3>0.8,说明II中平衡时应该存在 c(NO2)>c(O2);
C.如果III中NO和氧气完全转化为二氧化氮,则c(NO2)=0.5mol/L,且容器中还有 c(O2)=0.1mol/L剩余,与I相比,III是相当于增大压强,平衡逆向移动,二氧化氮和氧气之和所占体积比大于50%;
D.v正=v (NO2 )消耗=k正c2(NO2 ),v逆=v(NO)消耗=2v (O2 )消耗=k逆c2 (NO)•c(O2 ),
达到平衡状态时正逆反应速率相等,则k正c2(NO2 )=k逆c2 (NO)•c(O2 ),且k正=k逆,则c2(NO2 )=c2 (NO)•c(O2 ),化学平衡常数K等于1.
解答 解:A.I中的反应2NO2(g)?2NO(g)+O2 (g)
开始(mol/L)0.6 0 0
反应(mol/L)0.4 0.4 0.2
平衡(mol/L)0.2 0.4 0.2
化学平衡常数K=$\frac{0.{4}^{2}×0.2}{0.{2}^{2}}$=0.8
容器体积为1L,则平衡时I中气体总物质的量=1L×(0.2+0.4+0.2)mol/L=0.8mol,
恒容恒温时气体压强之比等于其物质的量之比,如果平衡时I、II中压强之比为4:5,则II中平衡时气体总物质的量为1mol,II中开始时浓度商=$\frac{0.{5}^{2}×0.2}{0.{3}^{2}}$=$\frac{5}{9}$<0.8,则平衡正向移动,平衡正向移动导致混合气体总物质的量之和增大,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于 4:5,故A错误;
B.如果II中平衡时 c(NO2)=c(O2),设参加反应的 c(NO2)=xmol/L,则0.3-x=0.2+0.5x,x=$\frac{1}{15}$,
平衡时 c(NO2)=c(O2)=$\frac{7}{30}$mol/L,c(NO)=0.5mol/L+$\frac{1}{15}$mol/L=$\frac{17}{30}$mol/L,II中$\frac{(\frac{17}{30})^{2}×\frac{7}{30}}{(\frac{7}{30})^{2}}$≈1.3>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),容器I中 c(O2 )/c(NO2=1,所以达平衡时,容器Ⅱ中 c(O2 )/c(NO2 )小于1,则 比容器Ⅰ中的小,故B错误;
C.如果III中NO和氧气完全转化为二氧化氮,则c(NO2)=0.5mol/L,且容器中还有 c(O2)=0.1mol/L剩余,与I相比,III是相当于增大压强,平衡逆向移动,二氧化氮和氧气之和所占体积比大于50%,则达平衡时,容器Ⅲ中 NO 的体积分数小于50%,故C正确;
D.v正=v (NO2 )消耗=k正c2(NO2 ),v逆=v(NO)消耗=2v (O2 )消耗=k逆c2 (NO)•c(O2 ),
达到平衡状态时正逆反应速率相等,则k正c2(NO2 )=k逆c2 (NO)•c(O2 ),且k正=k逆,则c2(NO2 )=c2 (NO)•c(O2 ),化学平衡常数K等于1,该温度下的K大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1,故D正确;
故选CD.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析、计算及灵活运用知识解答问题能力,如果单纯的根据设未知数计算要涉及一元三次方程而难以解答,这需要学生灵活运用知识巧妙的避开一元三次方程而解答问题,题目难度较大.


科目:高中化学 来源: 题型:选择题
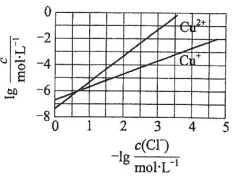 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )| A. | Ksp(CuCl)的数量级为10-7 | |
| B. | 除Cl-反应为Cu+Cu2++2Cl-=2CuCl | |
| C. | 加入Cu越多,Cu+浓度越高,除Cl-效果越好 | |
| D. | 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O | |
| D. | 配制1 L 0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水显酸性的主要原因:HClO?H++ClO- | |
| B. | 向氯水中滴加少量NaHCO3溶液:H++HCO3-═CO2↑+H2O | |
| C. | SO2具有漂白性,向氯水中通入少量SO2,溶液的漂白能力降低 | |
| D. | 常温时,氯水中含有的阴离子:Cl-、ClO-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
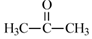 )分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
)分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| B. | 原子半径:X>Y>Z>W | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | X分別与Z、W形成的化合物中,所含化学键类型相同 | |
| C. | X、Y形成的最简单化合物的电子式为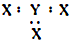 | |
| D. | Z分別与X、W均可形成具有漂白性的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com