
【题目】下列说法正确的是
A. 苯和溴苯的混合物可用CCl4分离
B. 蛋白质和聚乙烯均属于天然有机髙分子化合物
C. 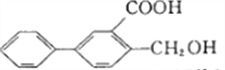 的苯环上的一氯代物有6种(不含立体异构)
的苯环上的一氯代物有6种(不含立体异构)
D. CH3CH2OH和 CH3CO18OH 发生酯化反应生成 CH3CO18OCH2CH3和H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于某有机物的性质叙述不正确的是

A. 1 mol该有机物完全燃烧可生成12molCO2
B. lmol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等
C. 1 mol该有机物可以与5mol H2发生加成反应
D. 1 mol该有机物可以与2 molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:
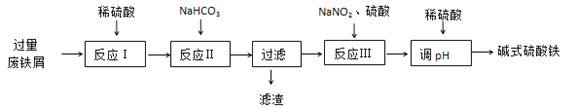
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 ___________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_____________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=_____mol。
(5)用稀硫酸调节体系的pH时,若硫酸加入量过少,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理说明其原因______________________________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
(1)甲用右图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。
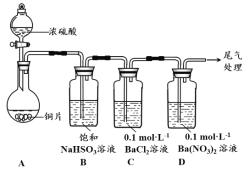
① A中反应的化学方程式是 。
② 为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变。 甲据此得出结论:D中出现白色沉淀的主要原因是 。
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究。
序号 | 实验操作 | 实验现象 |
1 | 取0.3 g 纯净Na2SO3固体,向其中加入10 mL 2 mol·L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4 min后,溶液变浑浊 |
2 | 取0.3 g 纯净Na2SO3固体,向其中加入10 mL 2 mol·L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2 h后,溶液变浑浊 |
3 | 取0.3 g 纯净Na2SO3固体,向其中加入10 mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
结合化学用语解释实验1中产生现象的原因: ; 。
由实验1、2、3对比,可以得到推论: 。
③ 乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取 固体混合物,向其中加入10 mL 2 mol·L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20 min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii.实验1和4对比,乙获得推论: 。
④ 通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加 (填字母序号)。
a.2 mol·L-1盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
b.2mol·L-1盐酸,再滴加BaCl2溶液,立即出现白色沉淀
c.2 mol·L-1硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
d.2 mol·L-1硝酸,再滴加BaCl2溶液,立即出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 1mol苯酚中“C=C”的个数为3NA
B. 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
C. 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为![]() NA
NA
D. 常温常压下,22.4L丙烷所含有的共价键数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C10H14,不能使溴水褪色,但可使酸性KMnO4溶液褪色,分子结构中只含一个烷基,则此烷基的结构有( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。某化学兴趣小组在实验室中对Cl2与FeCl2和KSCN混合溶液的反应进行了探究。回答下列问题:
(1)氯气的制备

①氯气的发生装置可以选择上图中的_________,反应的化学方程式为_________________。
②欲收集一瓶干燥纯净的氯气,选择上图中的装置,其连接顺序为______________(按气流方向,用小写字母表示)。
(2)Cl2与FeCl2和KSCN混合溶液的反应

随着Cl2不断通入,A装置中溶液先变红,后由红色变为黄色。
装置B中发生反应的离子方程式为___________________________________________。
(3)实验探究
为了探究A装置中溶液由红色变为黄色的原因,该小组进行了如下实验:
实验一:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成。
实验二:取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
该兴趣小组根据实验现象,猜想是SCN可能被Cl2氧化了,他们又进行了如下研究。
查阅资料显示:SCN的电子式为![]() 。
。
①该兴趣小组认为SCN中碳元素没有被氧化,理由是____________________________。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN中被氧化的元素是________(填元素名称)。
③通过实验证明了SCN中氮元素转化为NO3,他们的实验方案是__________________________________________________________________________________________________。
根据以上实验探究结论写出SCN与Cl2反应的离子方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com