
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液中:c(H+)=c(OH-)<c(NH4+)=c(Cl-) | |
| B. | 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 向Na2CO3溶液中逐滴滴加稀盐酸时,溶液中c(HCO3-)的变化情况是先变小后变大 | |
| D. | 0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1 NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
分析 A.依据电荷守恒c(H+)+c(NH4+)=c(OH-)+c(Cl-)分析判断;
B.加水稀释促进醋酸电离,溶液中氢离子浓度、醋酸根离子浓度减小,根据水的离子积常数确定氢氧根离子浓度变化;
C.向碳酸钠的浓溶液中逐滴加入稀盐酸,发生的反应依次为:CO32-+H+=HCO3-,HCO3-+H+=CO2↑+H2O,据此分析;
D.0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1 NaHCO3溶液等体积混合,溶液中存在物料守恒,2n(Na)=3n(C).
解答 解:A.常温下,混合溶液中pH=7说明溶液呈中性,则溶液中c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-),c(H+)=c(OH-)<c(NH4+)=c(Cl-),故A正确;
B.加水稀释能促进醋酸电离,溶液中c(H+)、c(CH3COO-)、c(CH3COOH)减小,温度不变,Kw不变,则c(OH-)增大,故B错误;
C.碳酸钠为二元弱酸对应的正盐,逐滴加入盐酸,先发生反应生成酸式盐,反应的离子方程式为:CO32-+H+═HCO3-,此时溶液中的碳酸氢根离子浓度逐渐增大,当完全生成碳酸氢根离子时,继续反应生成二氧化碳和水,反应的离子方程式为HCO3-+H+═H2O+CO2↑,溶液中的碳酸氢根离子浓度又逐渐减小,故C错误;
D.0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1 NaHCO3溶液等体积混合,溶液中存在物料守恒,2n(Na)=3n(C),3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+),故D正确;
故选AD.
点评 本题考查了电解质溶液中离子浓度大小比较,弱电解质电离平衡,盐类水解原理的应用,注意电解质溶液中物料守恒的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 22.4g | C. | 5.6g | D. | 56g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
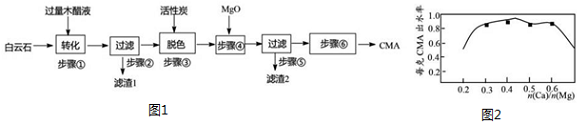
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
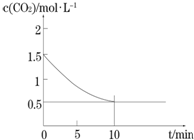 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 54.6 | 0.000 84 | 0.039 |
| A. | 已知MgCO3的Ksp=2.14×10-5 mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=2.14×10-5mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将适量的表中的三种物质分别与足量水混合,充分加热、灼烧,最终的固体产物相同 | |
| D. | 用石灰水处理水中的Mg2+和HCO3-,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
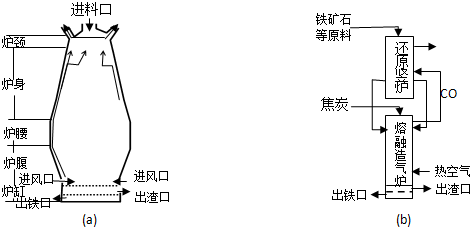
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | Z 的氧化物不具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点时溶液由无色变为浅红色且保持半分钟颜色不变 | |
| B. | 滴定终点时混合溶液的pH=7 | |
| C. | 滴定终点时反应的热效应即为中和热 | |
| D. | 滴定终点时两者恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 | |
| B. | 苯乙烯在一定条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴水反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com