

分析 (1)碳酸钠溶液水解显碱性,油污在碳酸钠溶液中水解生成溶于水的物质除去;
(2)操作Ⅱ是得到固体B和硫酸亚铁溶液,所以为过滤,根据过滤所用到玻璃仪器答题;
(3)根据锌比铁活泼,锌与盐酸反应比铁与盐酸反应速率快;
(4)根据过滤操作的步骤:过滤、洗涤、烘干等来分析;CuO能与盐酸反应生成氯化铜,氯化铜能和铁反应生成铜,此时铜、铁和酸能构成原电池,从而加快铁与稀硫酸的反应速率;
(5)A.(NH4)2Fe(SO4)2•6H2O加热,会失去结晶水,在试管口有液体生成;
B.含Fe2+溶液呈浅绿色,滴入2滴KSCN溶液,溶液不红色,再滴入 几滴新制氯水,Fe2+被氧化成Fe3+,Fe3+溶液遇KSCN,溶液变为血红色,所此可证明晶体的成分中含有Fe2+;
C.硫酸根离子在稀盐酸中无现象,再滴入几滴BaCl2溶液,有白色沉淀生成;
D.铵根离子溶液中加浓NaOH溶液,加热,会产生氨气,在试管口放置的湿润的红色石蕊试纸变蓝;
(6)如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀判断发生了氧化还原反应,亚硫酸根离子被铜离子氧化为硫酸根离子;
(7)由题意可知,消耗KMnO4溶液中的KMnO4的物质的量为10.00×10-3 L×0.2000mol/L=2.00×10-3mol,根据反应5Fe2++MnO${\;}_{4}^{-}$+8H═Mn2++5Fe3++4H2O,可知Fe2+的物质的量为5×2.00×10-3mol=1.00×10-2mol,据此求得Fe2+的质量分数.
解答 解:(1)碳酸钠溶液水解显碱性,油污在碳酸钠溶液中水解生成溶于水的物质除去,水和硫酸不能除去油污,操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂是碳酸钠溶液
故答案为:c;
(2)操作Ⅱ是得到固体B和硫酸亚铁溶液,所以为过滤,过滤用到玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:玻璃棒、漏斗;
(3)锌比铁活泼,锌与盐酸反应比铁与盐酸反应速率快,所以确定锌镀层被除去的标志是反应速率突然减小(或铁片表面生成的气泡突然减少),
故答案为:反应速率突然减小(或铁片表面生成的气泡突然减少);
(4)采用加热的方法制取硫酸亚铁铵,加热过程中,硫酸亚铁铵易失水,且亚铁离子易被氧气氧化,从而得不到硫酸亚铁铵晶体,
故答案为:避免加热过程中晶体受热分解失去结晶水或被空气氧化;
(5)A.(NH4)2Fe(SO4)2•6H2O加热,会失去结晶水,在试管口有液体生成,故A正确;
B.含Fe2+溶液呈浅绿色,滴入2滴KSCN溶液,溶液不红色,再滴入 几滴新制氯水,Fe2+被氧化成Fe3+,Fe3+溶液遇KSCN,溶液变为血红色,所此可证明晶体的成分中含有Fe2+,故B正确;
C.硫酸根离子在稀盐酸中无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,故C正确;
D.铵根离子溶液中加浓NaOH溶液,加热,会产生氨气,在试管口放置的湿润的红色石蕊试纸变蓝,故D错误;
故选:D;
(6)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,铜离子氧化亚铁离子为硫酸根离子,反应的离子方程式为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
故答案为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(7)由题意可知,消耗KMnO4溶液中的KMnO4的物质的量为10.00×10-3 L×0.2000mol/L=2.00×10-3mol,根据反应5Fe2++MnO${\;}_{4}^{-}$+8H═Mn2++5Fe3++4H2O,可知Fe2+的物质的量为5×2.00×10-3mol=1.00×10-2mol,所以Fe2+的质量分数为$\frac{1.00×10{\;}^{-2}×56}{4.000}$×100%=14%,
故答案为:14%.
点评 本题主要考查了物质的除杂与制备,涉及到物质的性质、离子的检验,氧化还原反应方程式的书写以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | K3C60中只有离子键 | B. | K3C60中碳元素显-3价 | ||
| C. | C60与12C互为同素异形体 | D. | 该晶体在熔融状态下能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤⑥ | D. | ①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题:
双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题: +4NaOH→2
+4NaOH→2 +NaOOCCOONa+2CH3CH2OH;
+NaOOCCOONa+2CH3CH2OH; ,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式
,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式 ,写出合成CPPO的化学方程式ClOC-COCl+2
,写出合成CPPO的化学方程式ClOC-COCl+2 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +2HCl,该反应是有一定限度的,加入有机碱三乙胺[(C2H5)3N]能提高目标产物的产率,其原因是有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移,;
+2HCl,该反应是有一定限度的,加入有机碱三乙胺[(C2H5)3N]能提高目标产物的产率,其原因是有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移,; 与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n
与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n +nClOC-COCl$\stackrel{一定条件}{→}$
+nClOC-COCl$\stackrel{一定条件}{→}$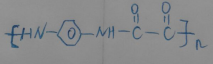 +2nHCl.
+2nHCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H4SiO4<H2CO3<H2SO4 | D. | 熔点:I2>Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑥ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com