
【题目】某烟道气的主要成分是CO2,并含有少量硫氧化物、氮氧化物等杂质。其中的硫元素可在高温下通过CH4的作用回收,主要反应如下:2SO2(g)+CH4(g)CO2(g)+2H2O(g)+S2(g)+Q(Q>0)
(1)以mol/(Lmin)为单位,SO2的反应速率是S2生成速率的_________倍。
(2)恒容条件下,不能说明该反应已经达到平衡状态的是_______(选填编号)
a.混合气体中水蒸气含量不再变化
b.混合气体密度不发生变化
c.容器内压强不再变化
d.混合物平均相对分子质量不再变化
达到平衡后升高体系温度,则平衡常数K_________(填“增大”、“减小”、或“不变”)。
(3)请在下式中标出上述反应中电子转移的方向和数目:_____
2SO2(g)+CH4(g)…该反应的氧化产物是_________。SO2的主要性质除氧化性、漂白性外还有________性。
(4)该反应混合物中有两种极性分子,分别是______和_____;固态硫的分子式可能是S8,它与S2互为________。
(5)烟道气中的NO2也能与CH4反应并生成无害气体,完全转化3.0molNO2气体时,需要甲烷的物质的量为__________mol.
【答案】2 b 减小 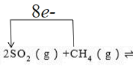 CO2 酸性氧化物 SO2 H2O 同素异形体 1.5
CO2 酸性氧化物 SO2 H2O 同素异形体 1.5
【解析】
(1)根据反应方程式分析,每消耗2molSO2,生成1molS2(g),则SO2的反应速率是S2生成速率的2倍;
(2)a.反应达到平衡时,各物质的浓度不再改变,所以混合气体中水蒸气含量不再变化,能说明化学反应是否达到平衡,故a不选;
b.反应物和生成物均为气体的反应,气体总质量反应前后质量守恒,保持不变,恒容容器体积不发生改变,则整个反应达到化学平衡前后,混合气体的密度都不变,不能根据密度说明化学反应是否达到平衡,故b选;
c.随着反应进行,气体分子数增加,气体压强增大,当容器内压强不再变化时,可以说明化学反应是否达到平衡,故c不选;
d.反应前后质量守恒,混合气体总质量不变,随着反应进行,混合气体的物质的量发生改变,所以当混合物平均相对分子质量不再变化时,可以说明反应是否达到平衡,故d不选;
综上所述答案为b;
该反应为放热反应,达到平衡后升高体系温度,平衡左移,平衡常数K减小;
(3)反应为氧化还原反应,SO2做氧化剂,在反应中得到电子,CH4做还原剂,在反应中失去电子,根据电子守恒可得电子转移数目为8,所以答案为: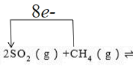 ;
;
反应中C元素化合价升高,氧化产物是CO2,SO2的主要性质除氧化性、漂白性外还有还原性和酸性氧化物的性质;
(4)极性分子是指分子中正负电荷中心不重合的分子,则分别是SO2和H2O;S8与S2为S元素的不同单质,互为同素异形体;
(5)烟道气中的NO2也能与CH4反应并生成无害气体,可判断为CO2和H2O和N2,反应的化学方程式为:2NO2+CH4=CO2+N2+2H2O,完全转化3.0molNO2气体时,根据反应方程式计算,则需要甲烷的物质的量为1.5mol。


科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是

A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃的结构简式为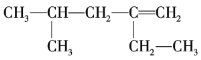 ,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
A.甲的命名中对主链的选择是错误的B.乙的命名中对主链碳原子的编号是错误的
C.丙的命名中对主链的选择是正确的D.丁的命名是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物在自然界中数目非常庞大,对此你认为下列解释不合理的是( )
A.碳原子能与其他原子形成四个共价键
B.有机化合物存在同分异构现象
C.碳是非金属元素
D.碳原子能与![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等多种非金属原子形成共价化合物,且原子连接方式多样
等多种非金属原子形成共价化合物,且原子连接方式多样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.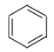 、
、 、
、 互为同系物
互为同系物
B.有机化合物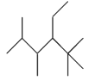 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.有机化合物![]() 的分子式为
的分子式为![]() ,且能与
,且能与![]() 溶液反应产生
溶液反应产生![]() ,其同分异构体有8种
,其同分异构体有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
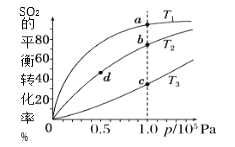
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
D.平衡常数:K(a)>K(c)、K(b)>K(d)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com