

| A. | 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体 | |
| B. | 在CaF2晶体中,每个晶胞平均占有4个Ca2+ | |
| C. | 在金刚石晶体中,碳原子与碳碳键数之比为1:2 | |
| D. | 该气态团簇分子的分子式为EH或HE |
分析 A、根据在NaCl晶体中,距Na+最近的Cl-有6个进行分析;
B、Ca2+位于晶胞的顶点和面心,利用均摊法计算;
C、根据用均摊法分析;
D、注意气态团簇分子与晶胞的区别.
解答 解:A、在NaCl晶体中,距Na+最近的Cl-有6个,而每个Na+离子为8个晶胞共有,则距Na+最近的多个Cl-构成正八面体,故A错误;
B、Ca2+位于晶胞的顶点和面心,晶胞中含有Ca2+的个数为:$8×\frac{1}{8}$+$6×\frac{1}{2}$=4,故B正确;
C、在金刚石晶体中,每个碳原子形成4个共价键,每两个碳原子形成一个共价键,则每个碳原子形成的共价键平均为$4×\frac{1}{2}$=2,所以在金刚石晶体中,碳原子与碳碳键数之比为1:2,故C正确;
D、气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4H4或H4E4,故D错误.
故选BC.
点评 本题考查晶胞的计算,题目难度较大,本题尤其注意气态团簇分子与晶胞的区别,为本题的易错点.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
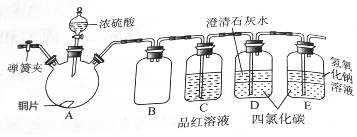 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 平衡时NH3的浓度(mol•L-1) | cl | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收bkJ | 吸收c kj |
| 体系压强(pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的草酸溶液含有H+数目为0.001NA | |
| B. | 当1molKMnO4被还原时强酸提供H+数目为NA | |
| C. | 1molHOOC-COOH含共用电子对数目为9NA | |
| D. | 该反应释放CO2分子数目为$\frac{V}{22.4}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W元素无同位素 | |
| B. | X单质分子中含共价键 | |
| C. | 简单离子半径:Y<Z | |
| D. | W、Y、Z不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列有关物质的性质和该性质的应用均正确的是( )
A.SO2具有氧化性,可用于漂白纸浆
B.炭具有还原性,一定条件下能将二氧化硅还原为硅
C.BaCO3、BaSO4都难溶于水,均可用做钡餐
D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com