
| A. | I2的量减少 | B. | 平衡逆向移动 | C. | ν(正)>ν(逆) | D. | HI转化率不变 |
科目:高中化学 来源: 题型:选择题
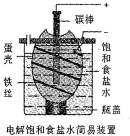 某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )
某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )| A. | 通电一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色 | |
| B. | 蛋壳表面缠绕的铁丝发生氧化反应 | |
| C. | 碳棒上产生的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,蛋壳外溶液的pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 反应前质量/g | 反应后质量/g | |
| U型管+固体 | a | b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料中不含任何化学物质 | |
| B. | 这种蒸馏水绝对纯净,不含任何离子 | |
| C. | 这种口服液含有丰富的氮、磷、锌等微量元素 | |
| D. | 没有水就没有生命 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3与沸水反应生成的胶体中含有NA个Fe(OH)3胶粒 | |
| B. | 1.12LNH3所含的原子数是0.2NA | |
| C. | 常温常压下,0.4molNa2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 1molNa2O2晶体中共含有4NA个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 36.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com