
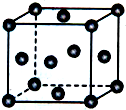
 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.| 1 |
| 2 |


科目:高中化学 来源: 题型:
 甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).| 10min | 20min | 30min | 40min | 50min | 60min | ||
| 3000C | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 | |
| 5000C | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、检验溶液中是否有SO
| ||
| B、检验溶液中是否有K+时,用灼烧过的铂丝蘸取试液,观察焰色是否呈紫色 | ||
C、检验溶液中是否有NO
| ||
D、检验溶液中是否含有CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
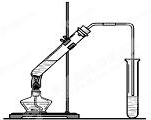 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、一定浓度的盐酸 | 饱和Na2CO3溶液 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NH3?H2O溶液能鉴别Al3+、Mg2+、Ag+、Cu2+ |
| B、配制一定物质的量浓度的稀H2SO4时,量筒量取浓溶液时若俯视读数,结果偏低 |
C、如图实验 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 |
| D、测定中和热时:取25 mL 10 mol/L的浓硫酸和25 mL 10 mol/L的NaOH溶液中和,测定反应放出的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com