
| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 2015年10月我国科学家屠呦呦获诺贝尔医学、生理学奖,她发现、创制的药物青篙素( )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 |
分析 A.合成纤维属于有机化合物;
B.地沟油属于油脂,油脂可发生皂化反应制肥皂;生物柴油是以动植物油脂、废餐饮用油等为原料与甲醇在催化剂作用下,进行酯交换制成的液体燃料;
C.大力实施矿物燃料“脱硫、脱硝技术”,可减少酸雨、光化学烟雾等污染;
D.中国科学家屠呦呦获2015年诺贝尔生理学或医学奖,她的团队从中药中分离出青蒿素应用于疟疾治疗.
解答 解:A.合成纤维属于有机化合物,不是无机非金属材料,光导纤维是新型无机非金属材料,故A错误;
B.地沟油经过皂化反应制肥皂,与甲醇在催化剂作用下进行酯交换制成生物柴油,故B正确;
C.大力实施矿物燃料“脱硫、脱硝技术”,可减少酸雨、光化学烟雾等污染,故C正确;
D.中国科学家屠呦呦获2015年诺贝尔生理学或医学奖,她的团队从中药中分离出青蒿素应用于疟疾治疗,已知青蒿素的分子式为C15H22O5,故D正确.
故选A.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
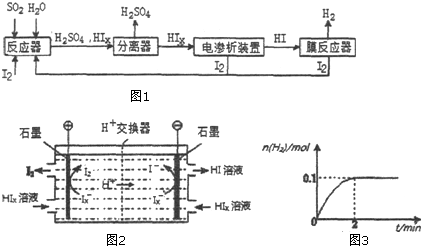
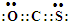 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

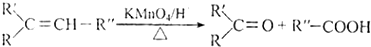
 .
. .
.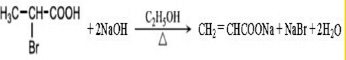 .
. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 g石墨中的C-C键数目 | |
| B. | 常温常压下,17 g ND3中所含分子数目 | |
| C. | 向含0.2 mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1 mol羟基(-OH)中所含电子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下的平衡常数为101.25 L/moL | |
| B. | 达到平衡时,SO2的转化率是90% | |
| C. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为231.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L1) | NaOH物质的量浓度(mol•Lˉ1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.1 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molAl3+离子含有的核外电子数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5NA个 | |
| D. | 标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com