
| A. | 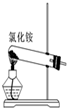 实验室用如图装置制取氨气 | |
| B. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| C. | 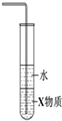 如图装置中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. | 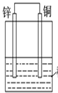 如图装置是原电池,锌电极为负极,发生还原反应 |
分析 A.氯化铵分解后,在试管口又化合生成氯化铵;
B.氢氧化亚铁易被氧化;
C.X若为四氯化碳,在下层,可隔绝气体与水;
D.Zn比Cu活泼,Zn作负极.
解答 解:A.氯化铵分解后,在试管口又化合生成氯化铵,则该装置不能制备氨气,应利用铵盐与碱共热制备,故A错误;
B.氢氧化亚铁易被氧化,则应在液面下挤出NaOH溶液,或隔绝空气,故B错误;
C.X若为四氯化碳,在下层,可隔绝气体与水,则图中装置可防止倒吸,故C正确;
D.Zn比Cu活泼,Zn作负极,负极失去电子发生氧化反应,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、物质的制备实验、倒吸装置、原电池等,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与应用能力的考查,注意实验的评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a+b+c}{V}$mol•L-1 | B. | $\frac{a+b+2c}{V}$mol•L-1 | C. | $\frac{2a+b+c}{V}$mol•L-1 | D. | $\frac{b+2c}{V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 g石墨中的C-C键数目 | |
| B. | 常温常压下,17 g ND3中所含分子数目 | |
| C. | 向含0.2 mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1 mol羟基(-OH)中所含电子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com