
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气)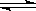 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为 ;平衡时,气体的总物质的量是 。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为 。
(1)0.4 5mol
(2)2<n(x)/n(y)<5
解析试题分析:(1)同温、同压条件下,充入物质的物质的量比与原平衡时的比值相同,则两个平衡等效。本题中,开始时X、Y的物质的量比是2:1,后来X、Y的物质的量比是4:2=2:1,所以再达平衡与原平衡等效,Z的体积分数仍是0.4;设Y转化xmol,则X转化2xmol,生成Z2xmol,则有2x/(4-2x+2-x+2x)=0.4,解得x=1,所以平衡时气体的总物质的量是4-2x+2-x+2x=5mol;
(2)设n(X)/n(Y)=a,Y转化xmol,根据(1)知平衡时气体总物质的量是n(X)+ n(Y)-x,则Z的体积分数=2x/(n(X)+ n(Y)-x)=0.4,即x/ n(Y)=(a+1)/6,也是Y的转化率。根据(1)的计算得知原平衡中Y的转化率是50%。保持容器的体积不变,与原平衡比压强减小,压强减小,平衡逆向移动,导致Z的体积分数小于0.4,要想保持Z的体积分数仍为0.4,所以需要增大压强,使平衡右移,Y的转化率将大于50%,所以(a+1)/6>50%,解得a>2;又可逆反应中Y的转化率(a+1)/6<1,解得a<5,所以2<a<5。
考点:考查等效平衡的判断及计算


科目:高中化学 来源: 题型:填空题
在一定条件下,反应x A+YB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,则该反应的平衡常数表达式为_______________________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是___________;
(3)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(6分)把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度; (2) B的转化率;(3) x的值。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(7分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g)。2 min时生成0.3 mol W,此时测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 mol·L-1·min-1。
(2)计算n值和2 min末时Y的浓度(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末测得容器内的压强变为原来压强的1.05倍,且测知前2min内以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。
求:(1)前2 min内用X的浓度变化表示的平均反应速率?
(2)2min末Y的浓度?
(3)化学反应方程式中n的值?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
(1)达到平衡时CO2的物质的量分数和该反应的化学平衡常数;
(2)达到平衡后向该平衡体系中通入1.0mol水蒸气,达到新的平衡状态时,求水蒸气的物质的量和CO2的物质的量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ?molˉ1
CH3OH(g) △H=-129.0kJ?molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。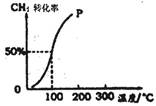
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为 。
②1000C时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.平衡常数K增大 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |

 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com