
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入1mL 0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅, 30 in后几乎变为无色 |
II | 向另一支试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1mL 0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
(1)高锰酸钾与草酸反应的离子方程式:______________________________________
(2)由实验I、II可得出的结论是____________________________。
(3)关于实验II中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性 KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,______,最后加入1mL 0.1mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
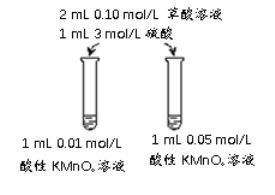
① 他们拟研究的影响因素是______。
② 你认为他们的实验方案______(填“合理”或“不合理”),理由是______。
【答案】2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O 其他条件相同时,H+(或硫酸)浓度越大,反应速率越快 再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体 加入草酸溶液后,溶液紫色迅速变浅(或溶液颜色开始变浅的时间小于80 s,或其他合理答案) KMnO4溶液浓度 不合理 KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢
【解析】
(1)高锰酸钾具有强氧化性,草酸有还原性,可发生氧化还原反应,生成硫酸锰、二氧化碳和水;
(2)对比实验I、II,加入酸的量不同,总体积相同,则氢离子浓度不同;
(3)①加入试剂的总体积仍旧为10滴溶液,且初始量(条件)与实验II相同,且需要加入一定量的硫酸锰;
②若Mn2+对反应有催化作用,加入草酸溶液后,则溶液迅速褪色;
(4)①根据图像信息,使用的高锰酸钾的浓度不同;
②高锰酸钾的浓度不同,导致溶液颜色深浅不同,设计不合理。
(1)高锰酸钾具有强氧化性,草酸有还原性,可发生氧化还原反应,生成硫酸锰、二氧化碳和水,离子方程式为2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O;
(2)对比实验I、II,加入酸的量不同,总体积相同,则氢离子浓度越大,反应速率越快;
(3)①加入试剂的总体积仍旧为10滴溶液,且初始量(条件)与实验II相同,且需要加入一定量的硫酸锰溶液,则再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体;
②若Mn2+对反应有催化作用,加入草酸后,则溶液迅速褪色;
(4)①根据图像信息,使用的高锰酸钾的浓度不同,则探究因素为高锰酸钾的浓度对反应速率的影响;
②高锰酸钾溶液有颜色,高锰酸钾的浓度不同,导致溶液颜色深浅不同,无法通过比较褪色时间长短判断反应快慢,设计不合理。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是()
①过氧化钠加入水中:![]()
②用小苏打治疗胃酸过多:![]()
③实验室用石灰石和盐酸反应制取![]() :
:![]()
④![]() 与
与![]() 反应:
反应:![]()
⑤氯化铁溶液中加铁粉![]()
⑥将过量的![]() 通入NaOH溶液中
通入NaOH溶液中 ![]()
A.①③④⑥B.②⑤C.①②③④D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为N![]() ,关于反应
,关于反应 下列说法错误的是
下列说法错误的是
A.8.8gCO2中共用电子对的数目为0.8NA
B.消耗CO24.48L(标准状况下)时转移电子的数目为0.8NA
C.12g金刚石(C)中所含共价键的数目为4NA
D.0.1molMgO中所有离子的最外层电子数之和为1.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于煤、石油和天然气为原料的化工生产中,不经处理直接排放会引起大气污染,石油化工中产生的羰基硫可通过以下方法脱除。
Ⅰ.干法脱除:在催化剂存在下,COS和H2可发生两个平行反应:
i. COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=-17kJ/mol
H2S(g)+CO(g)△H1=-17kJ/mol
ii. COS(g)+4H2(g)![]() H2S(g)+CH4(g)+H2O(g) △H2
H2S(g)+CH4(g)+H2O(g) △H2
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
(2)T1℃时,向10L恒容密闭容器中充人1molCOS和4molH2,发生反应i和ii。5min时达到平衡,测得体系压强减少了20%,CO的体积分数为10%且其平衡分压为P1。
①0-5min内,v(COS)=______________。
②反应i的平衡常数K=______________。
③若在起始温度为T1℃的绝热容器中重复上述实验,H2的平衡分压P2______________P1(填“>”“=”或“<”),理由为______________。
Ⅱ.湿法脱除:原理为COS+4OH-=S2-+CO32-+2H2O。温度为293K时,将COS以固定流速匀速通入一定浓度的NaOH溶液中,测得体系内c(S2-)随时间(t)的变化如图所示:
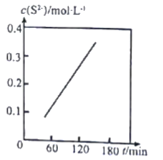
(3)由图可知,增大NaOH溶液的初始浓度,COS的吸收速率______________(填“增大”“减小”或“不变”),判断依据为______________。
(4)在上述反应体系中同时加入少量溴水,也能吸收COS并得到澄清溶液,发生反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从乙醛工业中产生的废钯(Pd)催化剂(钯5-6%,炭93-94%,铁、铜、锌、镍1-2%)中提取PdCl2和CuCl2的工艺流程如图所示:
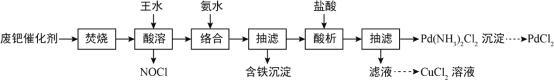
已知:钯、铜、锌、镍可与氨水形成Pd(NH3)42+等络离子。请回答:
(1)“焚烧”的主要目的为______________,实验室中可在______________(填仪器名称)中模拟该过程。
(2)“酸溶”时,Pd转化为PdCl2,其化学方程式为______________;该过程需控温70-80℃,温度不能太低或太高的原因为______________。
(3)“络合”时,溶液的pH需始终维持8-9,则络合后溶液中含铁离子的浓度≦______________。(已知:Fe(OH)2、Fe(OH)3的Ksp甲分别为4×10-17、2.8×10-39)
(4)“酸析”时生成沉淀的离子方程式为______________。
(5)流程中回收得到的PdCl2和CuC12在乙烯直接氧化制乙醛的催化体系中联合发挥作用,反应机理如下:
i.![]() ;
;
ii.______________;
iii.![]() 。
。
ii的化学方程式为______________。
(6)上述提取PdCl2和CuCl2方案的缺点是______________(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OHˉ =BaSO4↓ +H2O
B.氯气和水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.向碳酸钙中滴加醋酸溶液:CaCO3+2H+ =Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末可能是Cu、Fe2O3、Cu2O中的一种或几种,为探究其组成,称a g该固体粉末样品,用过量的稀H2SO4充分反应后(已知:Cu2O+2H+=Cu+Cu2++H2O),最终还剩下固体且称量得质量为b g。则下列推断不合理的是( )
A.最后剩余的固体只有Cu
B.反应后溶液中大量存在的阳离子最多有3种
C.b的取值范围:0<b≤a
D.若b =![]() a,则红色固体粉末一定为纯净物
a,则红色固体粉末一定为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于氨气的催化氧化反应:4NH3 +5O2 =4NO + 6H2O
(1)该反应中的还原剂是________,被还原的元素是_________ ;
(2)用单线桥标出该反应中电子转移的方向和数目;4NH3 +5O2 =4NO + 6H2O_________
(3)若反应转移了2mol电子,则产生的气体在标准状态下体积约为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com