
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:推断题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
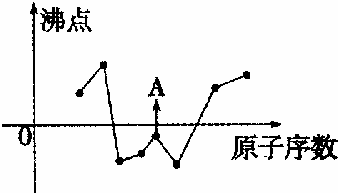
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
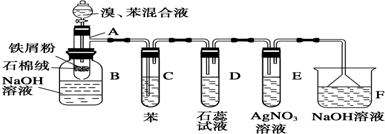
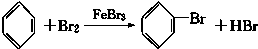 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体中每个钠离子与周围6个氯离子形成6个离子键 | |
| B. | 前四周期元素的原子中,未成对电子数最多的是Mn | |
| C. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| D. | 岩浆冷却过程中,晶格能高的矿物晶体先结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次升高 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | B、C、N、O、F原 子半径依次升高 | |
| D. | Li、Na、K的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为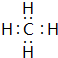 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com