
| A. | pH=4的CH3COOH溶液中,由水电离出来的c(H+)=1.0×10-4mol•L-1 | |
| B. | 物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中c(NH4)+:①<② | |
| C. | pH=3的0.1mol•L-1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) |
分析 A.常温下Kw=1.0×10-14,pH=4的CH3COOH溶液中,由水电离出来的c(H+)=$\frac{Kw}{1{0}^{-4}}$;
B.设均为1mol/L时,NH4HSO4溶液中氢离子浓度接近1mol/L,而(NH4)2SO3溶液中铵根离子浓度小于2mol/L;
C.NaHC2O4溶液,电离显酸性,电离大于其水解;
D.溶液中存在质子守恒式.
解答 解:A.常温下Kw=1.0×10-14,pH=4的CH3COOH溶液中,由水电离出来的c(H+)=$\frac{Kw}{1{0}^{-4}}$=1.0×10-10mol•L-1,故A错误;
B.设均为1mol/L时,NH4HSO4溶液中氢离子浓度接近1mol/L,而(NH4)2SO3溶液中铵根离子浓度小于2mol/L,但c(NH4)+:①>②,故B错误;
C.NaHC2O4溶液,电离显酸性,电离大于其水解,则离子浓度为c(Na+)>c(HC2O4-)>c(H+)>c(OH-),故C正确;
D.溶液中存在质子守恒式为c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),故D错误;
故选C.
点评 本题考查离子浓度大小的比较,为高频考点,把握kw与氢离子浓度的关系、盐类水解及电离为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的易错点,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
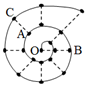 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 原子半径大小顺序:r(B)>r(C)>r(A) | |
| B. | B、C最高价氧化物的水化物可以相互反应 | |
| C. | 虚线相连的元素处于同一族,A、C元素都位于元素周期表ⅥA族 | |
| D. | A分别与B、C形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
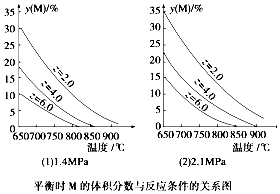
| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 1 | C. | 0.5 | D. | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
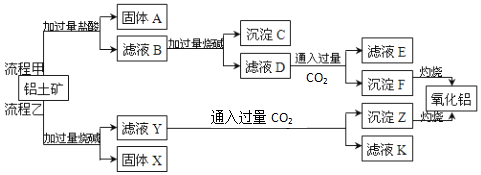
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟利昂-12的结构式为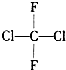 ,该分子是平面型分子 ,该分子是平面型分子 | |
| B. | 苯与液溴混合后撤入铁粉发生了加成反应 | |
| C. | 分子式为C4H9Cl的同分异构体共有4种 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com