
| A. | 开发新能源,减少对化石能源的依赖 | |
| B. | 将燃煤进行脱硫处理,可减少酸雨的形成 | |
| C. | 雾霾(颗粒直径为2.5 x103 nm)具有丁达尔效应 | |
| D. | 推广使用电动汽车,可减少城市雾霾的形成 |
分析 A.化石能源的燃烧能够产生大量的空气污染物;
B.二氧化硫使形成酸雨的主要气体;
C.胶体分散质粒子直径大小为1-100纳米,具有丁达尔效应;
D.化石燃料的燃烧形成一些碳粒、烟尘,PM2.5,是形成雾霾的主要原因.
解答 解:A.开发新能源,减少对化石能源的依赖,能够减少污染物的判断,有利于环境保护,故A正确;
B.将燃煤进行脱硫处理,能够减少二氧化硫的排放,能够减少酸雨的形成,故B正确;
C.胶体分散质粒子直径大小为1-100纳米,颗粒物直径大小2.5×10-6m>100纳米,因此这些细颗粒物分散在空气中形成的混合物是浊液而不是胶体,因此不具有丁达尔效应,故C错误;
D.推广使用电动汽车,减少汽油的使用,能够减少碳粒、烟尘,PM2.5的排放,可减少城市雾霾的形成,故D正确;
故选:C.
点评 本题考查了生活中常见的环境污染与治理,熟悉雾霾的成因、减少雾霾的措施是解题关键,注意三种分散质的本质区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
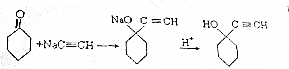
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
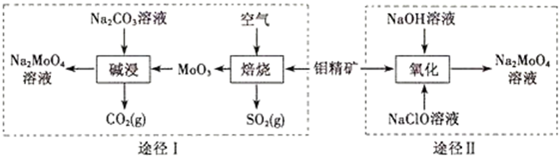

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
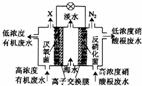 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )| A. | 中间室中的 Cl-向左室移动 | |
| B. | 左、右两室溶液混合后所得溶液的酸性:反应前<反应后 | |
| C. | X气体为CO2 | |
| D. | 左边离子交换膜为阴离子交換膜,右边离子交换膜为阳离子交換膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
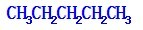 ;
;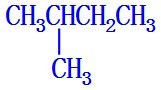 ;
;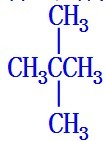 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是一种清洁能源 | B. | CH4•nH2O是一种离子化合物 | ||
| C. | 可燃冰在常温常压下能稳定存在 | D. | 可燃冰是天然气冷却后得到的固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com