
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。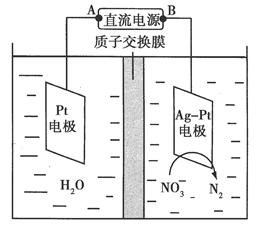
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12。
①N2的结构式为________。
②上述反应离子方程式为____________________,其平均反应速率v(NO3-)为________mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法________。
(2)电化学降解NO3-的原理如图所示。
①电源正极为________(填“A”或“B”),阴极反应式为______________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)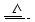 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)
A.酸 B.碱 C.盐 D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中 (填写化学式,下同)失去电子,氧化剂是 。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有 (填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是 (填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为 L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式 计算需要NaOH溶液的体积 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型
与氧化还原反应的关系”也可用如图表达。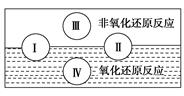
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将5.5 g铁铝混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体。
(1)HNO3是否过量___________。
(2)若a=3.36L(标准状况),则混合物中铝的质量分数为_________%。
(3)若a=3.36L(标准状况),往反应后的溶液中加入___________ mL 1.000 mol/L NaOH溶液时生成的沉淀量最大,还要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不变。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)
__________ _____________________________________________________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。说出NaBiO3的一个性质:
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:
反应器中主要发生的反应为:
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2Δ Na2SiO3+CO2↑
Ⅲ.Al2O3+2NaOHΔ 2NaAlO2+H2O
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245g KClO3参加反应,则转移的电子数为_____________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________
___________________________。
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为__________________________,离子方程式为_______________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母)
A.重结晶 B.萃取分液 C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-=NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________。
(2)反应中硝酸体现了______________、______________的性质。
(3)反应中若产生0.2 mol气体,则转移的电子的物质的量是________ mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法有两种。
方法1 还原沉淀法
该法的工艺流程为 。
。
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。
Cr2O72-(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O72-的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com