
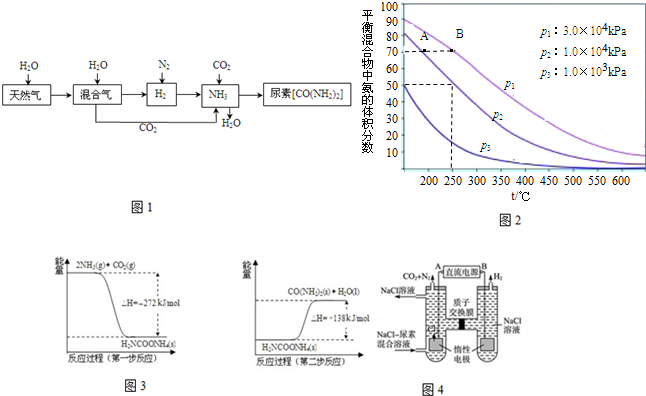
分析 (1)甲烷与水蒸气反应生成一氧化碳和氢气;
(2)①温度越大,压强越大,反应速率越大;
②化学平衡常数只与温度有关;
(3)由图示可知,第一步:2NH3(g)+CO2(g)?H2NCOONH4(l,氨基甲酸铵)△H1=-272KJ/mol,
第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(s)△H2=+138KJ/mol,
根据盖斯定律,两个过程相加得到NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1;
由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl;
(4)铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,以此书写离子方程式.
解答 解:(1)甲烷与水蒸气反应生成一氧化碳和氢气,该反应为CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2,
故答案为:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2;
(2)①温度越大,压强越大,反应速率越大,由图可知,B对应的温度、压强大,则反应速率大,
故答案为:<;
②化学平衡常数只与温度有关,显然温度不变,则化学平衡常数K不变,
故答案为:不变;
(3)由图示可知,第一步:2NH3(g)+CO2(g)?H2NCOONH4(l,氨基甲酸铵)△H1=-272KJ/mol,
第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(s)△H2=+138KJ/mol,
根据盖斯定律,两个过程相加得到NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1;
由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
(4)铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该离子反应为2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-,
故答案为:2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-.
点评 本题考查制备实验方案的设计,综合性较强,题目难度较大,涉及化学平衡及计算、离子反应、氧化还原反应,热化学反应等高考常考考点,注重学生能力的训练,把握图象及数据处理即可解答.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、OH-、SO42-、MnO4- | ||
| C. | Na+、Mg2+、NO3-、SO42- | D. | Na+、Fe3+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用二氧化硫漂白纸浆、毛、丝、草帽辫等,是因为二氧化硫的还原性能使有色物质被氧化而褪色 | |
| B. | 过氧化钠用于呼吸面具作为氧气的来源,是因为过氧化钠具有强氧化性能氧化二氧化碳 壶水生成氧气 | |
| C. | 向盐碱地(含较多的NaCl、Na2C03)中施加适量石膏,可降低土壤的碱性,是因为石膏能与 Na2C03反应生成CaC03沉淀 | |
| D. | 在被保护的锅炉内壁,装上镁合金或锌块,以减少锅炉的腐蚀,是因为镁、锌比铁活泼,这样连接使锅炉做为原电池的负极被保护下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112 mL | B. | 224 mL | C. | 448 mL | D. | 560 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com