
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
分析 (3)用浓度为0.1mol•L-1的盐酸进行滴定,待测液为NaOH,取待测液选择碱式滴定管,用酚酞作指示剂时,锥形瓶中溶液的颜色为红色,滴定终点时变为无色;
(4)由表格数据可知,第二次误差较大,可舍弃,消耗盐酸的体积为$\frac{26.11mL+26.09mL}{2}$=26.1mL,由NaOH+HCl=NaCl+H2O可知,n(HCl)=n(NaOH);
(5)结合c(NaOH)=$\frac{c(盐酸)V(盐酸)}{V(NaOH)}$及不当操作对V(盐酸)的影响可知,V(盐酸)偏大,则所测氢氧化钠溶液的浓度偏高.
解答 解:(3)待测液为NaOH,取待测液选择碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止,且30s内不变色,
故答案为:碱式滴定管;红;无;
(4)由表格数据可知,第二次误差较大,可舍弃,消耗盐酸的体积为$\frac{26.11mL+26.09mL}{2}$=26.1mL,由NaOH+HCl=NaCl+H2O可知,c(NaOH)=$\frac{0.0261L×0.1mol/L}{0.025L}$=0.1044mol/L,故答案为:0.1044mol/L;
(5)A.中和滴定达终点时俯视滴定管内液面度数,V盐酸的体积偏小,则NaOH的浓度偏小,故A不选;
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定,对实验无影响,故B不选;
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定,消耗V(盐酸)偏大,则所测氢氧化钠溶液的浓度偏高,故C选;
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定,盐酸浓度偏低,V(盐酸)偏大,则所测氢氧化钠溶液的浓度偏高,故D选;
故答案为:CD.
点评 本题考查物质含量的测定,为高频考点,把握滴定操作、仪器的使用、误差分析为解答的关键,侧重分析与实验能力的考查,注意数据处理及浓度的计算,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,单位物质的量的气体所占的体积就叫气体的摩尔体积 | |
| B. | 物质的量是表示一定数目粒子集合体的一个物理量 | |
| C. | 0.012kg的碳中所含的碳原子数就是阿伏伽德罗常数 | |
| D. | Al原子的摩尔质量为27g,Al3+因少了3个电子,摩尔质量更小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
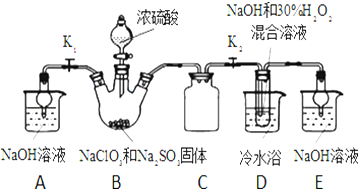
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
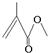 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
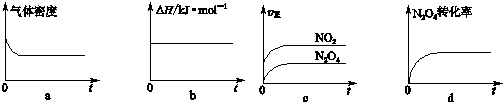
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
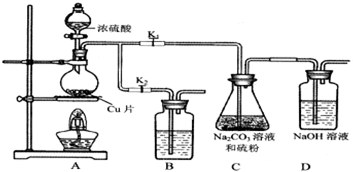
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com