
a、b、c、d、e五种短周期主族元素,在元素周期表中的相对位置如下表。b与d可以形成两种常见的化合物,下列说法错误的是
|
| a | b |
|
c |
|
| d | e |
A.元素c的氧化物具有两性
B.原子半径的大小顺序为:a>b>c>d>e
C.b元素在地壳中的含量居第一位
D.元素d的非金属性小于e
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
某课外实验小组设计的下列实验不合理的是


A装置①制备并观察氢氧化亚铁 B.装置②证明过氧化钠与水反应放热


C.装置③比较KMnO4、Cl2、 D.装置④测定盐酸的浓度
I2的氧化性强弱
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列图示与对应的叙述相符的是
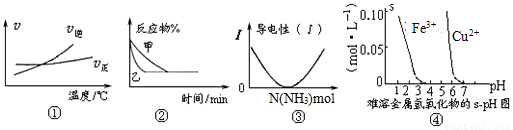
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
3C(g)+D(g)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.据图④,若除去0.1mol·L-1 CuSO4溶液中混有的Fe3+,可向溶液中加入适量NaOH至pH约为7
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
A.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2 AlO2-+H2O
B.二氧化锰与浓盐酸混合加热:MnO2+2Cl-+2H+=Cl2↑+Mn2++H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
D.硫酸氢钠溶液中滴入Ba(OH)2溶液使所得溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列化学用语正确的是
A.Mg2+的电子式:
B. 甲烷的比例模型:
C.已知Ni与Co的化合价均只有+2和+3,则在Ni0.25Co0.75(OH)2中Ni的化合价是+2
D.聚氯乙烯的结构简式:
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列关于有机物叙述不正确的是
A.甲烷制备四氯化碳发生取代反应,四氯化碳可萃取碘水中的碘
B.煤通过干馏,可以将煤中含有的苯、甲苯、二甲苯等芳香烃从煤中分离出来
C. 淀粉、纤维素最终均可以水解生成葡萄糖
D.氯乙烯、苯分子内所有原子均在同一平面中
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合4 题型:简答题
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺,将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是 。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵 D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有 。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II. FeCl3溶液浸取工艺其生产流程如下图所示

(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是 (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时,溶液中Pb2+物质的量浓度为 mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )

A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO+8H+
B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH-
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版复习专练1气体定量测定在实验中应用练习卷(解析版) 题型:实验题
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
实验一:定性研究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色退去;

②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性比氯水强的原因是 。
(2)依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有 (填写溶质的化学式)。
实验二:定量研究。
在圆底烧瓶底部,用一塑料网包住块状石灰石(过量)与150 mL饱和氯水反应,按下图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,将装置密封后再加热,煮沸烧瓶中的液体,量筒中的气体不再增加时停止实验。

请回答:
(3)实验结束后检测到量筒中收集到的气体除CO2外还有O2,请写出Ⅰ中产生O2的化学反应方程式 。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进(水槽中仍为水),最简单的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com