
【题目】科学家利用电解NaB(OH)4溶液制备H3BO3的工作原理如下图。 下列说法中正确的是

A.b膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%<b%
C.电子从左边石墨电极流出,先后经过a、b、c膜流向右边石墨电极
D.理论上每生成1molH3BO3,两极室共生成33.6L气体(标准状况)
【答案】B
【解析】
A.M室与电源正极相连为阳极,N室为阴极,则电解质溶液中阳离子向N室移动,阴离子向M室移动,电解过程中原料室中的B(OH)4-需要移动到产品室,且不能让产品室中氢离子移动到右侧,所以b膜为阴离子交换膜,故A错误;
B.原料室中的Na+会移动到阴极即N室,N室中发生电极反应2H2O+2e-=H2↑+2OH-,所以经N室后NaOH溶液浓度变大,所以NaOH溶液的浓度:a%<b%,故B正确;
C.电子不能在电解质溶液中移动,故C错误;
D.理论上每生成1molH3BO3,则M室中就有1mol氢离子通过a膜进入产品室即转移1mole-,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,M室生成0.25molO2、N室生成0.5molH2,则两极室共产生标准状况下16.8L气体,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
实验目的 | 实验方案 | 所选玻璃仪器 | |
A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
B | 证明CH3COOH与HClO的酸性强弱 | 相同温度下用pH试纸测定浓度均为0.1 mol·L-1NaClO、CH3COONa溶液的pH | 玻璃棒、玻璃片 |
C | 配制1 L 1.6%的CuSO4溶液(溶液密度近似为1 g·mL-1) | 将25 g CuSO4·5H2O溶解在975 g水中 | 烧杯、量筒、玻璃棒 |
D | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是
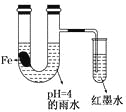
A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸阿比朵尔,适合治疗由 A、B 型流感病毒引起的上呼吸道感染,2020 年入选新冠肺炎试用药物,其合成路线:
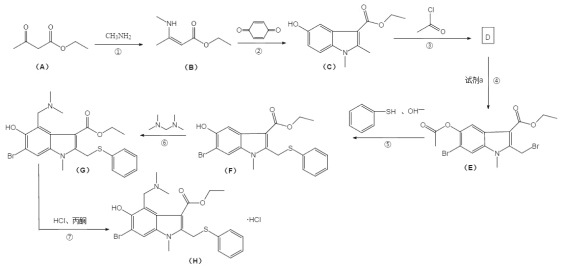
回答下列问题:
(1)有机物 A 中的官能团名称是______________和______________。
(2)反应③的化学方程式______________。
(3)反应④所需的试剂是______________。
(4)反应⑤和⑥的反应类型分别是______________、______________。
(5)I 是 B 的同分异构体,具有两性并能与碳酸氢钠溶液反应放出气体,写出具有六元 环结构的有机物 H 的结构简式______________。 (不考虑立体异构,只需写出 3 个)
(6)已知:两分子酯在碱的作用下失去一分子醇生成β—羟基酯的反应称为酯缩合反应,也称为 Claisen (克莱森)缩合反应,如: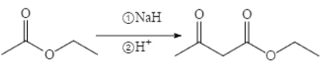 ,设计由乙醇和
,设计由乙醇和![]() 制备
制备 的合成线路______________。(无机试剂任选)
的合成线路______________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】倍他乐克是一种治疗高血压的药物,其中间体F合成路线如下:
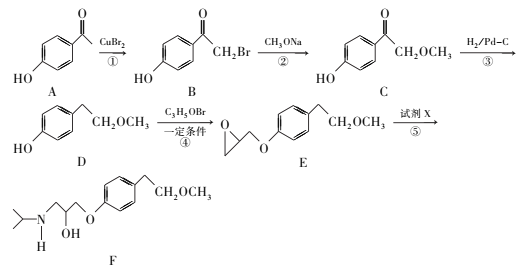
回答下列问题:
(1)A的分子式为____ 。 D中官能团的名称是____ 。
(2)B与足量NaOH溶液反应的化学方程式为____。
(3)D→E的反应类型为_____。
(4)反应⑤加入试剂X反应后只生成中间体F,则X结构简式为 ___。
(5)满足下列条件的C的同分异构体有_____种。
①能发生银镜反应;
②与NaOH溶液反应时,1molC最多消耗3molNaOH;
③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位。其中核磁共振氢谱有4种不同化学环境的氢,且峰面积比为1︰6︰2︰1的可能是____(写结构简式)。
(6)根据已有知识及题目相关信息,完成以 和CH3OH、CH3ONa为原料制备
和CH3OH、CH3ONa为原料制备 的合成路线流程图(无机试剂任选)____。
的合成路线流程图(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家认为,氢气是21世纪一种高效而无污染的理想能源。
(1)为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发较经济且资源可持续利用的制氢气的方法是___。
A.电解水 B.锌和稀硫酸反应 C.催化光解海水 D.分解天然气
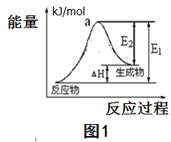
(2)用水分解获得氢气的能量变化如图1所示,则此反应的焓变△H=___kJ/mol。(请用关于E1,E2的代数式表示)。
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol﹣1
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol﹣1
则CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=___kJmol﹣1
(4)某固体酸膜氢氧燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图2所示,请按要求回答下列问题:

①b极上的电极反应式为___。
②此电池工作时每消耗4.48L(标准状况下)H2,转移电子___mol。
③若将这些电子用于铅蓄电池(两极板上分别覆盖有Pb、PbO2,电解质溶液是H2SO4溶液)充电,铅蓄电池中产生H2SO4的物质的量为___mol,铅蓄电池阳极发生的反应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
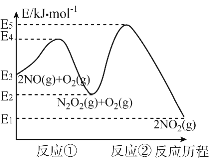
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com