
【题目】Ⅰ.已知:H2A的A2-可表示S2-、SO42-、SO32-、SiO32-或CO32-。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
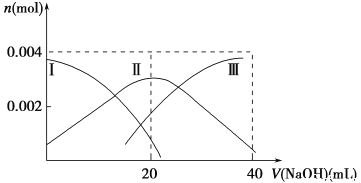
①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”)。
(2)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。
Ⅱ.已知:在25℃时,H2O![]() H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH ![]() H+ + CH3COO-,Ka=1.8×10-5;
H+ + CH3COO-,Ka=1.8×10-5;
(3)醋酸钠水解的平衡常数Kh具有数值__________。
(4)0.5mol/L醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为_______,a与b的关系为_________(填“大于”“小于”“等于”);
Ⅲ.(5)25℃时,将amol/L氨水与bmol/L盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3· H2O的电离平衡常数为_________。
【答案】 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 小 10-13 Kh=5.6×10-10 小于 大于 b·10-7/(a-b)
【解析】本题主要考查弱电解质的电离。
Ⅰ.(1)①当V(NaOH)=20 mL时,H2A转化为NaHA,由图可知c(A2-)>c(H2A,),说明HA-的电离程度大于水解程度,所以c(H+)>c(OH-)因此,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
②等体积等浓度的NaOH溶液与H2A溶液混合后,由于HA-的电离而使溶液呈酸性,HA-电离产生的H+抑制水的电离,因此,其溶液中水的电离程度比纯水小。
(2)若H2A为硫酸:t℃时,pH=2的稀硫酸中c1(H+)=10-2mol/L,由于稀硫酸与氢氧化钠溶液等体积混合后溶液呈中性,所以pH=11的NaOH溶液中c(OH-)=c1(H+)=10-2mol/L,氢氧化钠溶液中c2(H+=10-11mol/L,KW=c2(H+c(OH-)=10-13。
Ⅱ.(3)醋酸钠水解的平衡常数Kh=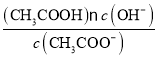 =
=![]() =5.6×10-10。
=5.6×10-10。
(4)醋酸钠溶液浓度越大,碱性越强,pH越大,所以m<n。醋酸钠溶液越稀,水解程度越大,所以a>b,
Ⅲ.(5)25℃时,将amol/L氨水与bmol/L盐酸等体积混合,NH3·H2O+HCl=NH4Cl+H2O,反应后溶液恰好显中性,此时氨水过量,c(![]() )≈c(Cl-)=0.5bmol/L,c(OH-)=1×10-7mol/L,c(NH3·H2O)=0.5(a-b)mol/L,NH3·H2O的电离平衡常数Kb=
)≈c(Cl-)=0.5bmol/L,c(OH-)=1×10-7mol/L,c(NH3·H2O)=0.5(a-b)mol/L,NH3·H2O的电离平衡常数Kb=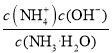 =10-7b/(a-b)。
=10-7b/(a-b)。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】已知:2Fe+3Br2═2FeBr3 , Fe2+的还原性大于Br﹣ . 现有16.8g铁和0.3mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2 . 下列叙述不正确的是( )
A.当a=0.1时,发生的反应为2Fe2++Cl2═2Fe3++2Cl﹣
B.当a=0.45时,发生的反应为2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣
C.若溶液中Br﹣有一半被氧化时,c(Fe3+):c(Br﹣):c(Cl﹣)=1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl﹣)+c(Br﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.200 mL 1 mol/L氯化钙溶液中c(Cl﹣)和100 mL 2 mol/L氯化钾溶液中c(Cl﹣)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制350mL1.0mol/LH2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/L)体积为多少?取25mL1.0mol/LH2SO4溶液与2g锌粉充分反应,产生标准状况下H2多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表明吸附与解吸作用的过程如图所示,下列说法正确的是
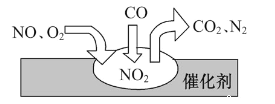
A. 反应中CO为氧化剂,N2为氧化产物
B. 催化转化总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
C. NO和O2必须在催化剂表面才能反应
D. 汽车尾气的主要污染成分包括CO、NO和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg、Al合金投人50mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加2.5mol/L的NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如图所示,下列说法正确的是

A. 原合金中Mg质量为2g B. 原合金中Al质量为2.35g
C. HCl的物质的量浓度为8mol/L D. C点的溶质只为氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、A12O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。

已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
请回答:
(1)K2Cr2O7中K元素的原子结构示意图为____________,化合价是_______________。
(2)往铬铁矿里通入氧气的主要目的是__________________。滤液1的成分除Na2CrO4外,还含有_____(填化学式)。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式
是________________________。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是____________________。
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、__________ 、过滤、洗涤、干燥。
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com