
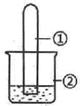
 用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | HCHO | 新制Cu(OH)2悬浊液 | 产生白色沉淀 |
| D | CH3Cl | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化氮与水反应生成硝酸和NO,NO不溶于水;
B.二氧化硫与水反应生成亚硫酸,溶液显酸性;
C.HCHO与新制Cu(OH)2悬浊液加热反应生成砖红色沉淀;
D.CH3Cl不能电离出氯离子.
解答 解:A.二氧化氮与水反应生成硝酸和NO,NO不溶于水,则试管中不能充满无色溶液,故A错误;
B.二氧化硫与水反应生成亚硫酸,溶液显酸性,则紫色石蕊溶液变为红色,故B正确;
C.HCHO与新制Cu(OH)2悬浊液加热反应生成砖红色沉淀,不是白色沉淀,故C错误;
D.CH3Cl不能电离出氯离子,与硝酸银溶液不能发生反应,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象为解答该题的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | X与Y的转化率相等 | |
| C. | 该温度下的平衡常数约为9.3×10-3 | |
| D. | 重新建立平衡时Z的浓度为0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
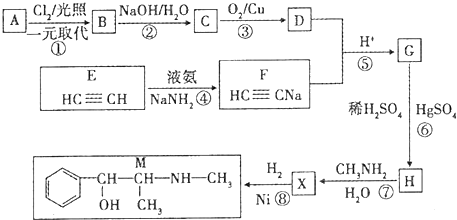
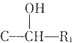
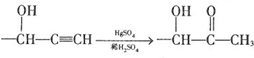
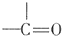 $→_{H_{2}O}^{RNH_{2}}$
$→_{H_{2}O}^{RNH_{2}}$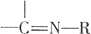
 .
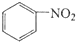
.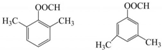 .
. $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$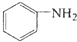 参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体
参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体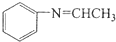 的路线
的路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 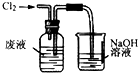 用装置甲氧化废液中的溴化钠 | B. | 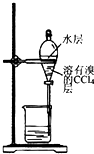 用装置乙分离CCl4层和水层 | ||
| C. |  用装置丙分离CCl4和液溴 | D. |  用仪器丁长期贮存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
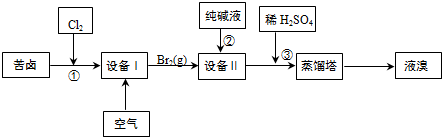
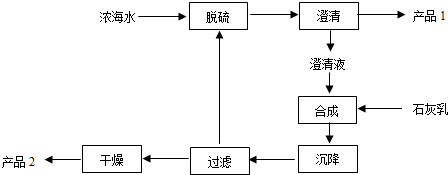
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 医用酒精属于混合物,醋酸是一元弱酸 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、糖和醋都可做食品防腐剂 | |
| B. | 青蒿素可以用于治疗疟疾 | |
| C. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com