
对于反应2X(g) + Y(g)  2Z(g),K表示平衡常数,下列说法正确的是
2Z(g),K表示平衡常数,下列说法正确的是
A.当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大
B.随着反应正向进行,Z的浓度不断增大,X、Y的浓度不断减小,平衡常数不断增大
C.温度发生变化,上述反应的K值也发生变化
D.可逆反应达到平衡时,逆反应便立即停止了
科目:高中化学 来源:2014-2015甘肃省张掖市高三第三次诊断考试理综化学试卷(解析版) 题型:选择题
某课外活动小组的同学从某地颗粒采集器中获得雾霾颗粒样品,然后用蒸馏水浸取。在探究雾霾颗粒可溶性成分的实验中,下列根据实验现象得出的结论不正确的是
A.向浸取液中滴入AgNO3溶液有白色沉淀产生,说明雾霾中可能含有Cl-
B.向浸取液中滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42-
C.向浸取液中加入Cu和浓H2SO4,试管口有红棕色气体产生,说明雾霾中可能含有NO3-
D.向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有NH4+
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高一上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下浓硫酸能与金属铜反应,还能与非金属如碳、硫等反应,这是因为
A.浓硫酸的酸性很强 B.浓硫酸的脱水性很强
C.浓硫酸的氧化性很强 D.浓硫酸的沸点很高
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用 量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗盐酸溶液体积/mL | 19.00 | 23.00 | 23.04 |
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有 _____
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用标准稀盐酸溶液润洗
D.滴定到达终点时,俯视读出滴定管读数;
E.酸式滴定管尖嘴部分有气泡,滴定后消失
F.摇动锥形瓶时有少量液体溅出瓶外
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq) + CH3COOH(aq) = CH3COONa(aq) + H2O(l);△H = -57.4kJ·mol-1
B.已知C(石墨,s)= C(金刚石,s);△H>0,则石墨比金刚石稳定
C.已知反应2H2(g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1,则H2的燃烧热为571.6kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高二上学期期末考试化学试卷(解析版) 题型:选择题
在2A﹢B 2C﹢D反应中,表示该反应速率最快的是
2C﹢D反应中,表示该反应速率最快的是
A.v(A)=0.8mol·L-1·s-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.6mol·L-1·s-1 D.v(D)=0.5mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:填空题
(11分) I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是 (用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-)
B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-)
D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol·L-1。混合溶液中离子浓度c(A-) c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度 NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是__________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。
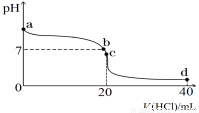
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列有关AgCl沉淀的溶解平衡的说法,正确的是
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度不变
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com