


分析 (1)①分析图谱中温度不同的谱线结合E中镁元素的质量分数可知,E为氧化镁;“一段脱水”的目的是制备MgCl2•2H2O,温度不高于180℃的目的是因为温度过高会生成MgOHCl或MgO;
②依据生成的MgOHCl与阴极产生的Mg反应生成MgO,氯化镁和氢气,依据原子守恒分析书写;
③制备金属镁工艺的关键流程分析,循环使用的物质是加入后在反应过程中有重新生成分析判断;
(2)氧化还原反应电子转移守恒计算;
(3)依据“镁-次氯酸盐”燃料电池的装置图中所示的变化写出正极反应式.
解答 解:(1)①分析图谱中温度不同的谱线结合E中镁元素的质量分数可知,MgO中镁元素质量分数=$\frac{24}{24+16}$×100%=60%,判断E为氧化镁;“一段脱水”的目的是制备MgCl2•2H2O,温度不高于180℃的目的是因为温度过高会生成MgOHCl或MgO,
故答案为:MgO;若温度太高,MgCl2转化为MgOHCl或MgO;
②生成的MgOHCl与阴极产生的Mg反应生成MgO,氯化镁和氢气,反应的化学方程式为:2MgOHCl+Mg=2MgO+MgCl2+H2↑,
故答案为:2MgOHCl+Mg=2MgO+MgCl2+H2↑;
③制备金属镁工艺的关键流程分析,循环使用的物质是加入后在反应过程中有重新生成的物质,分析可知是氯气和氯化氢,
故答案为:HCl、Cl2;
(2)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol;
故答案为:3mol;
(3)“镁-次氯酸盐”燃料电池的装置图中微粒变化分析可知,ClO-在正极放电,生成Cl-,结合碱性的环境,可写出正极反应式:ClO-+2e-+H2O=Cl-+2OH-,
故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评 本题考查了物质制备实验的分析判断,原电池原理和电极原理的分析应用,图象分析能力,侧重分析与实验能力的综合考查,为高频考点,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当C电极共产生11.2L(标准状况)气体时,生成了1 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24L CO 和O2 混合气体中含有的碳原子数目为0.1NA | |
| B. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA | |
| C. | 常温常压下,48g O3含有的分子数为3NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下:
邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①将镁带用砂纸擦后,放入试管中,加入少量水后,加热至水沸腾;再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②将一小块金属钠放入滴有酚酞试液的冷水反应 | (B)反应不十分剧烈,产生的气体可在空气中燃烧 |
| ③镁带与2mol/L的稀盐酸反应 | (C)剧烈反应,产生的气体可在空气中燃烧 |
| ④铝条与2mol/L的稀盐酸反应 | (D)生成白色胶状沉淀,继而沉淀消失 |
| ⑤向AlCl3溶液滴加NaOH溶液 | (E)产生大量气体,可在空气中燃烧,溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


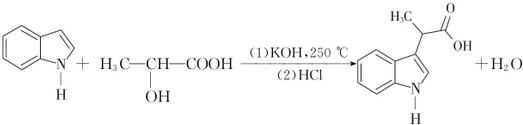
 .
. .
. (填结构简式).
(填结构简式). 经如下步骤合成:
经如下步骤合成:
 的反应类型为还原反应,反应条件2为催化剂、加热,其反应的化学方程式为
的反应类型为还原反应,反应条件2为催化剂、加热,其反应的化学方程式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com