
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3COOH和HCOOCH3 | D. | CH3CH2CHO和CH3COCH3 |
分析 依据同分异构体有碳链异构,官能团的位置异构,物质类别异构进行分析判断.
解答 解:A、CH3CH2CH2CH3和CH3CH(CH3)2分子式相同,碳链的结构不同,属于碳链异构,故A正确;
B、CH2=CHCH2CH3和CH3CH=CHCH3分子式相同,官能团双键的位置不同,故B错误;
C、CH3COOH和HCOOCH3分子式相同,官能团不同,分别为羧酸和酯类,物质类别不同,故C错误;
D、CH3CH2CHO和CH3COCH3分子式相同,物质类别不同,分别属于醛和酮,故D错误,故选A.
点评 本题主要考查的是有机物的同分异构体的概念,同分异构体中有碳链异构、官能团异构、位置异构、顺反异构等,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 核电荷数为17的元素的原子的质量数一定是35 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.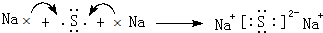 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.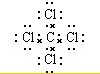 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
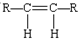 和
和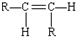 两种空间排列的形成,那么,下列化合物具有上述两种空间排列形成的是( )
两种空间排列的形成,那么,下列化合物具有上述两种空间排列形成的是( )| A. | 丙烯 | B. | 2-戍烯 | C. | 苯乙烯 | D. | 1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com