
���� 10s���ƽ��״̬���������������ѹǿΪ��ʼѹǿ��5/6����ת����O2Ϊx��
2SO2��g��+O2��g��?2SO3��g��
��ʼ 2 1 0
ת�� 2x x 2x
ƽ�� 2-2x 1-x 2x
��$\frac{3-x}{3}=\frac{5}{6}$�����x=0.5mol��
��1�����v=$\frac{��c}{��t}$��KΪ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȼ��㣻
��2���Ȼ�ѧ����ʽ��Ϊ��ȫת���������仯�����÷�ӦΪ���淴Ӧ��K���¶��йأ�
��3��ֻ����2mol SO3��T��ʱ��ַ�Ӧ��ƽ�����������Ϊc kJ������ƽ��״̬��ͬ������Ӧ���淴Ӧ�������仯֮�͵��ڷ�Ӧ�ȵľ���ֵ��
��4�������������зֱ�ͨ��x mol SO2 ��g����y mol O2 ��g����z mol SO3 ��g������ʹ�ﵽ��ƽ��ʱ����������ѹǿ��Ϊ��ʼѹǿ��$\frac{5}{6}$��Ϊ��Чƽ�⣬����ת��Ϊ��Ӧ��ʱ���ʵ�����ͬ����ƽ�������ƶ���x����ƽ��ʱ�����ʵ�����
��5����Ϊ��ѹ��������Ӧǰ�����ͬ������ʼʱ����2mol SO2��1mol O2��������Ӧʱn��С��V��С���൱�ڼ�ѹ��ƽ�������ƶ��ij̶ȱ��
��� �⣺10s���ƽ��״̬���������������ѹǿΪ��ʼѹǿ��5/6����ת����O2Ϊx��
2SO2��g��+O2��g��?2SO3��g��
��ʼ 2 1 0
ת�� 2x x 2x
ƽ�� 2-2x 1-x 2x
��$\frac{3-x}{3}=\frac{5}{6}$�����x=0.5mol��
��1��10s�ڸ÷�Ӧ��ƽ������v��O2��=$\frac{\frac{0.5mol}{2L}}{10s}$=0.025 mol•L-1•s-1��ƽ�ⳣ��K=$\frac{��\frac{1mol}{2L}��^{2}}{��\frac{1mol}{2L}��^{2}����\frac{0.5mol}{2L}��}$=4��
�ʴ�Ϊ��0.025 mol•L-1•s-1��4��
��2���Ȼ�ѧ����ʽ��Ϊ��ȫת���������仯�����÷�ӦΪ���淴Ӧ����2mol SO2������ȫ��Ӧ����֪a��b��T��ʱK=4��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=16���÷�ӦΪ���ȷ�Ӧ������ƽ�������ƶ�����T1��T��
�ʴ�Ϊ����������
��3��ֻ����2mol SO3��T��ʱ��ַ�Ӧ��ƽ�����������Ϊc kJ������ƽ��״̬��ͬ������Ӧ���淴Ӧ�������仯֮�͵��ڷ�Ӧ�ȵľ���ֵ��������a=b+c��
�ʴ�Ϊ��a=b+c��
��4���������������зֱ�ͨ��x mol SO2 ��g����y mol O2 ��g����z mol SO3 ��g������ʹ�ﵽ��ƽ��ʱ����������ѹǿ��Ϊ��ʼѹǿ��$\frac{5}{6}$��Ϊ��Чƽ�⣬����ת��Ϊ��Ӧ��ʱ���ʵ�����ͬ����x+z=2��y+$\frac{z}{2}$=1��
�ʴ�Ϊ��x+z=2��y+$\frac{z}{2}$=1��
����ʹ��ʼʱ��Ӧ����Ϊ������Ӧ������У�������������֪ƽ��ʱSO2Ϊ1mol����x��ȡֵ��ΧΪ1��x��2��
�ʴ�Ϊ��1��x��2��
��5����Ϊ��ѹ��������Ӧǰ�����ͬ������ʼʱ����2mol SO2��1mol O2��������Ӧʱn��С��V��С���൱�ڼ�ѹ��ƽ�������ƶ��ij̶ȱ����ų�����Ϊd kJ��bkJ���ʴ�Ϊ������
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ�����η���ƽ���ƶ������ʼ�K�ļ��㡢��Чƽ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע���Чƽ��Ϊ�����ѵ㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{n��m-x��}{m}$ | B�� | $\frac{n��m-x+2��}{m}$ | C�� | $\frac{m-x+2}{m-x}$ | D�� | $\frac{n��m-x-2��}{m}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
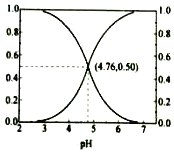 25��ʱ���ں�CH3COOH��CH3COO������Һ�У�CH3COOH��CH3COO�������и�����ռ�����ʵ�����������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ�������
25��ʱ���ں�CH3COOH��CH3COO������Һ�У�CH3COOH��CH3COO�������и�����ռ�����ʵ�����������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | ��pH��4.76����Һ�У�c��CH3COO-����c��CH3COOH�� | |
| B�� | ��pH=7����Һ�У�����CH3COOH��=0������CH3COO-��=1.0 | |
| C�� | ��pH��4.76����Һ�У�c��CH3COO-����c��OH-��֮�Ϳɴ���c��H+�� | |
| D�� | ��pH=4.76����Һ�м����ᣬ����CH3COOH�������CH3COO-��֮�ͱ��ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ��Ҫ���� | ���� |
| A | ���ھƾ������պ��ͭ˿Ѹ�ٲ�����ˮ�Ҵ��� | ͭ˿��� | CH3CH2OH����������Ӧ����CH3COOH��ͭ˿������� |
| B | �ֱ��ڱ����Ҵ��еμ����Ը��������Һ | �Ϻ�ɫ����ȥ | �����Ҵ����л�ԭ�� |
| C | �ֱ���ˮ���Ҵ��� �������� | ���������� | ����������Ϊ���� |
| D | ���ƾ��ڿ����е�ȼ | ������ɫ���� | �ƾ�����������Ӧ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| T/�� | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�ô��к���30%���ҵ����� | |
| B�� | �����ڼ���������ˮ��ɵø��� | |
| C�� | Ϊ���ӷ�Ч������ľ�����̬���ʻ��ʩ�� | |
| D�� | ��pH��ֽ�ɼ���ʳ������Σ�NaNO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ��ֻ�����ӣ�û�����ʷ��� | |
| B�� | ��Һ��ֻ�����ʷ��ӣ�û������ | |
| C�� | ��������ʵĵ��뷽��ʽ�У����á��T����ʾ | |
| D�� | ��Һ�з��Ӻ�����ͬʱ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com