
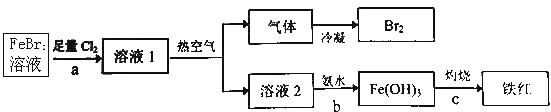
 震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.分析 (1)用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明二者反应生成氨气、和碳酸氢钠;
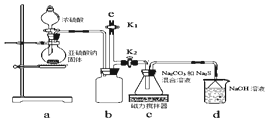
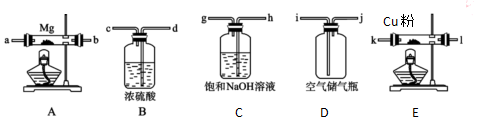
(2)实验一:a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气,据此分析;
实验二:④Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;
⑤计算消耗硝酸银物质的量,再根据方程式Ag++2CN-=[Ag(CN)2]-计算出氰化钠的含量.
解答 解:(1)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(2)实验一:a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气,
①由仪器构造可知为圆底烧瓶;b装置为安全瓶,防止倒吸,
故答案为:圆底烧瓶;安全瓶或防倒吸;
②d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;
故答案为:Na2SO3;
③实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,为防止拆除装置时污染空气,应再关闭K2打开K1;
故答案为:NaOH溶液;防止拆除装置时污染空气;
实验二:④Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,且半分钟内不消失,说明反应到达滴定终点;
故答案为:滴入最后一滴溶液,出现黄色沉淀,且半分钟内不消失;
⑤消耗AgNO3的物质的量为2.5×10-3L×0.0001mol/L=2.50×10-7mol,
根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为2.50×10-7mol×2×49g/mol=2.45×10-5g,废水中氰化钠的含量为$\frac{2.45×1{0}^{-2}mg}{0.025L}$=0.98mg/L>0.50mg/L,处理后的废水未达到达到排放标准,不能排放;
故答案为:0.98;不能.
点评 本题考查物质制备实验、物质含量测定等,题目综合性较强,关键是对原理的理解,注意制备中渗入环保意识,熟练掌握元素化合物知识与实验制备基本原则,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 氯化镁溶液中加入氢氧化钠溶液:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铝片放入过量浓NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将铜片放入过量稀HNO3溶液中:3Cu+8HNO3═3Cu2++6NO3-+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠粒投入100mL稀盐酸中,溶液质量减轻 | |
| B. | 加热氧化钠和过氧化钠固体混合物,固体质量减轻 | |
| C. | 铁钉放入氯化铜溶液中,固体质量增大 | |
| D. | 光照新制氯水,溶液的颜色变浅,酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
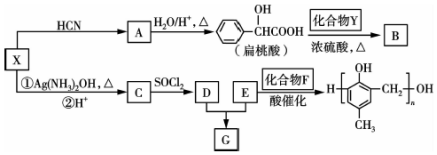
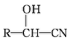 RCHO$→_{△}^{H_{2}O/H+}$
RCHO$→_{△}^{H_{2}O/H+}$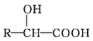
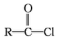 $\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基)
$\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基) .
.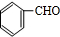 +2Ag(NH3)2OH$\stackrel{水浴△}{→}$
+2Ag(NH3)2OH$\stackrel{水浴△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+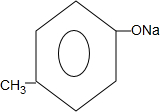 +H2O.
+H2O.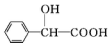 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式:
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式: .
.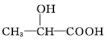 )的路线(其他无机试剂任选).合成路线流程图示例如下:
)的路线(其他无机试剂任选).合成路线流程图示例如下: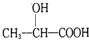 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com