
| A. | 在Na2CO3和NaHCO3溶液中离子种类相同 | |
| B. | 在溶质物质的量浓度和体积相等的Na2A和NaHA溶液中,阴离子总数相等 | |
| C. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2 c(CO32-) | |
| D. | 在Na2CO3溶液中一定有:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
分析 A、HCO3-能电离和水解,CO32-有两步水解;
B、A2-水解生成的阴离子增多;
C、根据溶液中的电荷守恒分析判断;
D、依据溶液中质子守恒分析判断.
解答 解:A、HCO3-能电离和水解,电离生成CO32-和H+,水解生成H2CO3和OH-,CO32-第一步水解生成HCO3-和OH-,第二步水解生成H2CO3和OH-,溶液中还存在H+,所以两种溶液中粒子种类相同,故A正确;
B、在溶质物质的量浓度相等的Na2A和NaHA溶液中,A2-水解生成的阴离子增多,故阴离子总数不相等,故B错误;
C、在NaHCO3溶液中一定有阴阳离子的电荷守恒,阳离子为Na+、H+阴离子为HCO3-、OH-、CO32-存在的电荷守恒为c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2 c(CO32-),故C正确;
D、在Na2CO3溶液中水电离出的氢离子和氢氧根离子相等,氢离子被CO32-结合为弱电解质,溶液中氢氧根离子大于氢离子,存在质子守恒,c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故选B.
点评 本题考查了弱电解质电离平衡的应用,盐类水解的应用,溶液中电荷守恒和质子守恒的书写原则,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
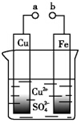
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol H2O中含有的原子总数为1.5 NA | |
| B. | 0.2mol O2 所占有的体积为4.48L | |
| C. | 22g 二氧化碳气体中所含有的分子数目为0.5 NA | |
| D. | 100mL2mol/L的Na2CO3溶液中含有的Na+数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③ | C. | ①③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两个电解池,甲池若为电解精炼铜的装置,请回答:
如图为相互串联的甲乙两个电解池,甲池若为电解精炼铜的装置,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的转化率为28.57% | B. | H2的转化率为85.7% | ||
| C. | N2的体积分数为20% | D. | H2的体积分数为10% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5s | B. | 4s | C. | 5s | D. | 10s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com