
| A. | NH5的电子式为: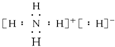 | |
| B. | 分馏、干馏、裂化都是化学变化 | |
| C. | 2-甲基-1-丁烯的结构简式: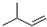 | |
| D. | NaHSO4和Na2O2的阴、阳离子个数比均为1:2 |
分析 A、NH5为离子混合物,由NH4+和H-构成;
B、煤的干馏是将煤隔绝空气加强热从而使煤发生复杂的分解的过程;
C、依据烯烃命名方法命名:选取含有碳碳双键的最长碳链,距离碳碳双键最近一端为1号碳;
D、NaHSO4由钠离子和硫酸氢根构成;Na2O2由2个钠离子和1个过氧根构成.
解答 解:A、NH5为离子混合物,分子中存在NH4+和H-,电子式为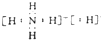 ,故A正确;
,故A正确;
B、石油的分馏是物理变化;煤的干馏是将煤隔绝空气加强热从而使煤发生复杂的分解的过程,是化学变化;裂化是由重油制得轻质油的过程,是化学变化,故B错误;
C、2-甲基-2-丁烯,在2、3号C之间含有碳碳双键,在2号碳上含有1个甲基,结构简式为:CH3C (CH3)=CHCH3,故C错误;
D、NaHSO4由钠离子和硫酸氢根构成,故阴阳离子个数之比为1:1;Na2O2由2个钠离子和1个过氧根构成,阴阳离子个数之比为1:2,故D错误.
故选A.
点评 本题考查了有机物的结构简式和键线式的区别、电子式的书写,题目难度中等,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确电子式书写规则,然后结合有机物的结构简式灵活运用即可.


科目:高中化学 来源: 题型:选择题
 美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | b极发生氧化反应 | |
| C. | 负极的反应为:4H++O2+4e-═2H2O | |
| D. | 电池工作时,1mol乙醇被氧化时有12mol转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. (C10H10O4)的同分异构体中,满足下列条件的有5种.
(C10H10O4)的同分异构体中,满足下列条件的有5种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
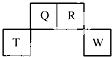 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨的化学反应限度最大 | |
| B. | N2的转化率最高 | |
| C. | 催化剂的活性最大 | |
| D. | NH3在平衡混合气体中的体积分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | 先出现白色沉淀后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热 | 若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使品红试液褪色 | |
| B. | 都能和氢氧化钠溶液反应生成盐和水 | |
| C. | 都有刺激性气味 | |
| D. | 常温下都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,违背了泡利不相容原理.
,违背了泡利不相容原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com